精准放疗在HCC中的应用和最新进展
时间:2025-02-27 12:09:53 热度:37.1℃ 作者:网络
随着现代精确放疗技术的迅速发展,放疗应用于肝细胞癌(HCC)患者的安全性和有效性已得到广泛证实。三维适形放疗(3D-CRT)、调强放疗(IMRT)和体部立体定向放疗(SBRT)等精准放疗技术的日益成熟和广泛应用,为肝癌治疗提供了新的机遇。为此,肝癌在线邀您共享北京大学肿瘤医院王维虎教授关于3D-CRT、IMRT、SBRT在HCC中的应用和最新进展,希望给大家的临床实践带来启迪。
肝癌放疗 全程精准
精准治疗既是一种理念,也是一种实践。在精准治疗的三要素(精准的患者选择、诊治团队精准地实施治疗、精准的治疗方法)中,特别强调诊治团队精准地实施治疗,要求做到全程“精准”,即:
➤ 精准的体位固定:包括呼吸控制
➤ 精准的靶区定义:基于MRI
➤ 精准的计划设计:正常器官保护
➤ 精准的计划实施:基于IGRT
1 精准靶区勾画
王维虎教授强调,实施上述“精准”治疗的前提是精准的靶区勾画。CT对于肝癌诊断的敏感性为68%-91%,MRI对于肝癌诊断的敏感性为77%-100%,尤其对于小肝癌(≤5cm)优势更加明显[1-4]。对于有瘤栓的患者,在CT图像中,瘤栓在静脉期显影更清晰,但MRI更具优势,可以三维显示瘤栓的位置,更有助于靶区的勾画[5]。
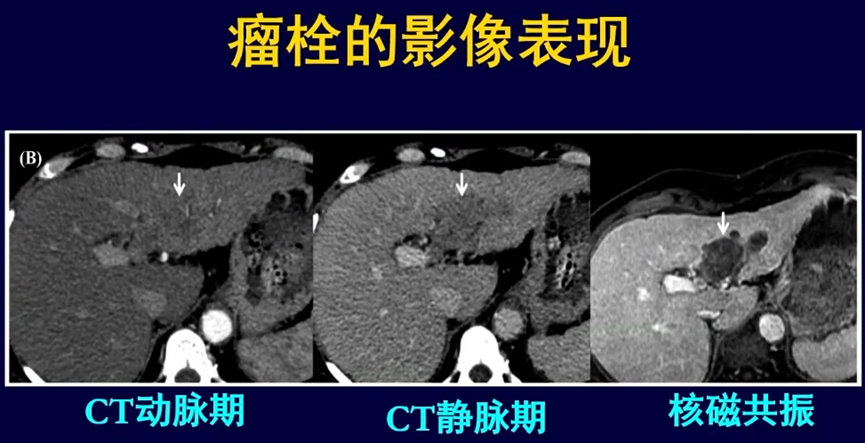
2 亚临床病变的确定
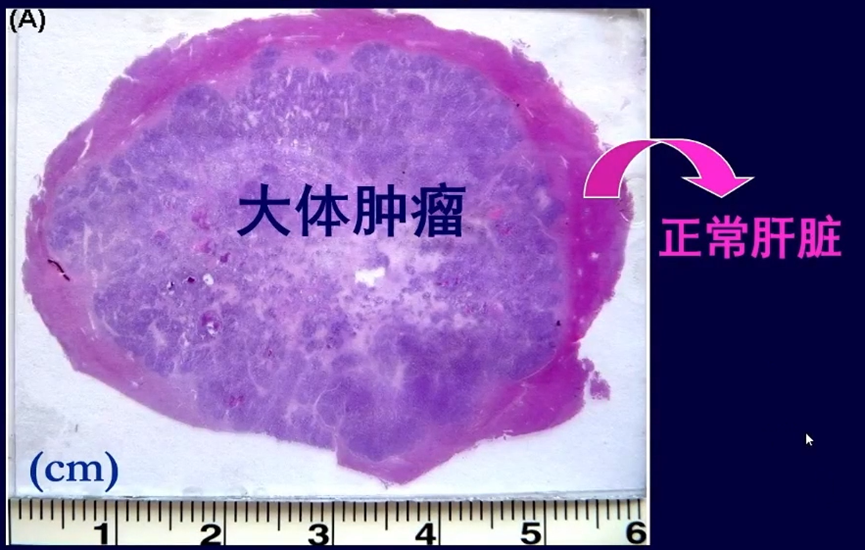
在放疗时,需要明确临床靶区(CTV)的大小。王维虎教授团队既往研究[6]表明,94.7%(72/76)的患者大体肿瘤外侵距离≤3.5mm,故推荐GTV外放5mm形成CTV。
SBRT在小肝癌中的长期疗效
有研究[7]纳入了2003年6月-2016年12月AJCC(第7版)分期T1、T2或T3a,不适合其他治疗或者其他治疗后失败,接受SBRT的297例HCC患者(436个病灶)。其中,有2-4个病灶的患者占29.6%,病灶>5cm者占19.0%,肝功能Child-Pugh分级为B/C级者占22%。该研究报道了SBRT后的长期疗效。
结果显示:SBRT后患者1年、3年和5年总生存(OS)率分别为77.4%、39.0%和24.1%,未出现典型放射性肝病(RILD),未出现4级肝脏毒副反应,15.9%的患者出现肝功能Child-Pugh分级的升高,只有1.3%的患者出现≥3级胃肠道毒副反应(溃疡、出血等)。
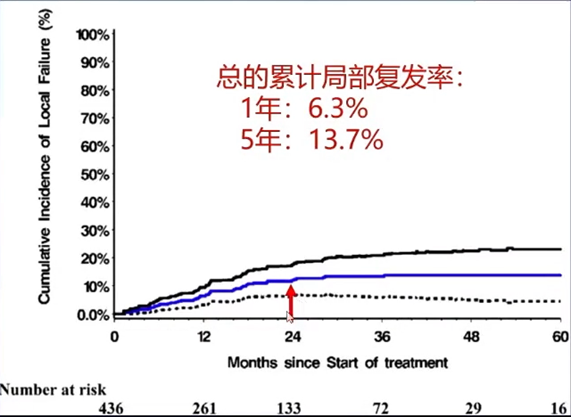
另有研究[8]对32项SBRT治疗HCC的研究进行了荟萃分析。共1950例患者纳入分析,其中,82.3%的患者为Child-Pugh A级,中位肿瘤大小为3.3cm(1.6-8.6cm),中位2Gy分次的等效剂量(EQD2)为83.3Gy(48-114.8Gy)。结果显示,SBRT后3年的局部控制率可达83.9%(77.6-88.6%),≥3级消化系统毒副反应发生率为3.9%,≥3级肝脏毒副反应发生率为4.7%。
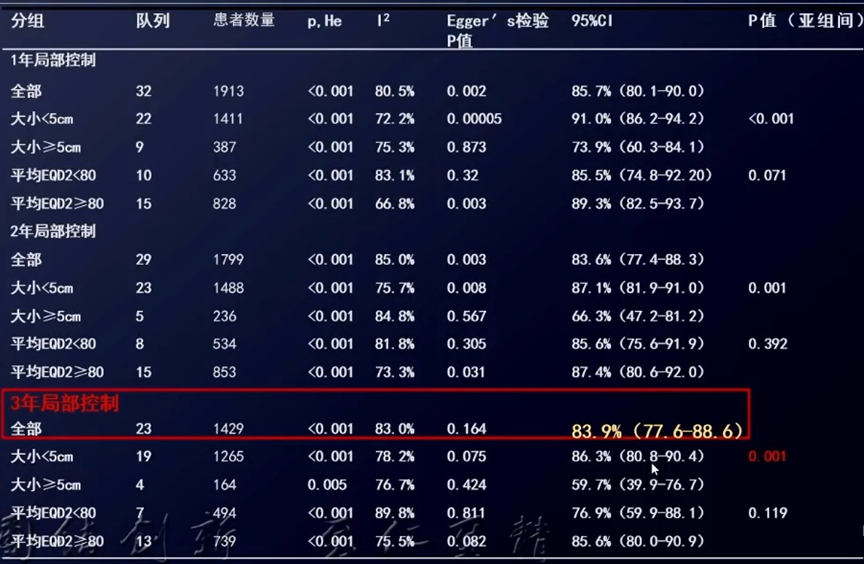
一项关于SBRT治疗HCC疗效和毒副反应的系统综述[9]纳入了48项前瞻性和回顾性研究,包括2846例患者(3088个病灶)。SBRT后总的1年、2年和3年局部控制率分别为91%(95%CI: 88-93%)、86%(95%CI: 82-89%)和84%(95% CI: 77-88%);总的1年、2年和3年OS率分别为78%(95%CI: 73-82%)、61%(95%Cl: 55-66%)和53%(95%CI: 45-61%)。3级毒副反应的人群加权中位发生率为6.5%,4/5级毒副反应的平均发生率为1.4%。
王维虎教授表示,对于小肝癌(≤5cm),指南建议手术治疗,但也有回顾性研究[10]发现,经倾向性评分匹配后,SBRT与手术在OS率和无进展生存(PFS)率方面相似。
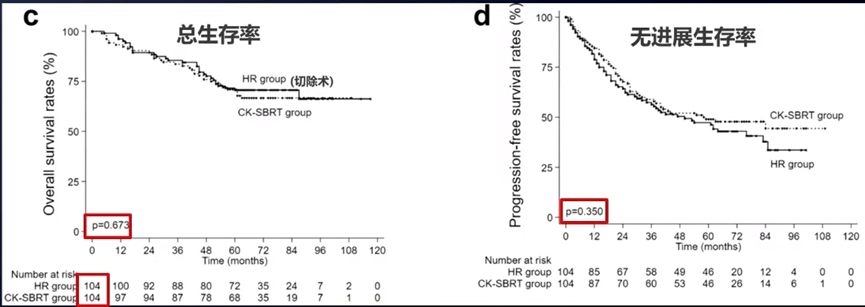
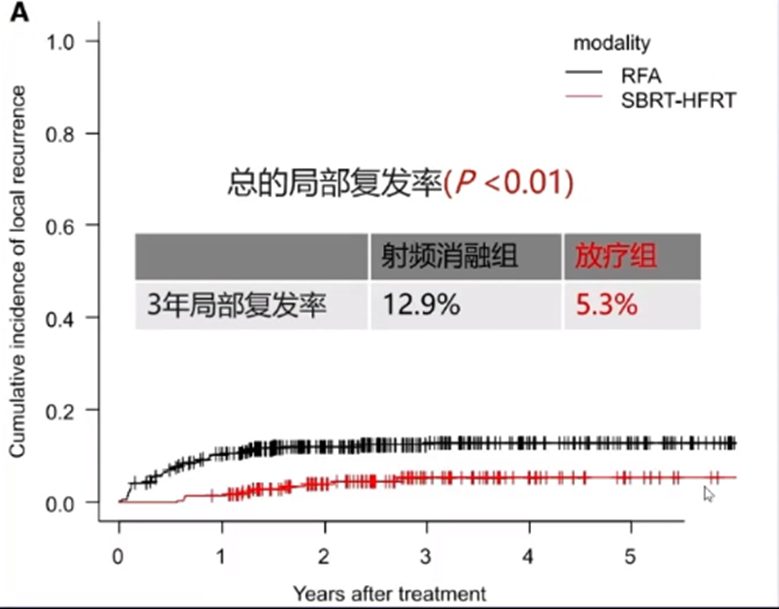
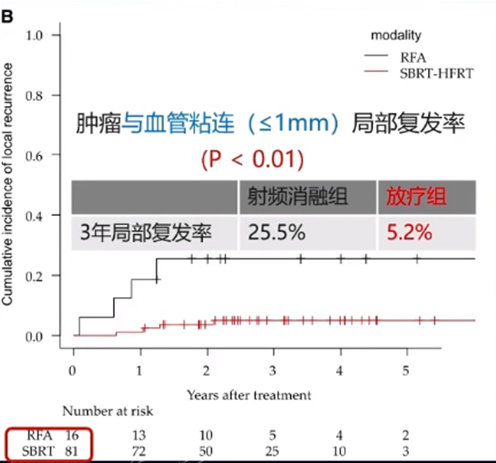
还有研究[11]对SBRT和射频消融(RFA)的疗效进行了比较。这项研究纳入了2012年-2016年间接受治疗的、肿瘤数目≤3个、肿瘤最大径≤3cm的不可手术HCC患者,其中231例(474个病灶)接受RFA治疗,143例(221个病灶)接受放疗[SBRT:35-40Gy/5f;大分割放疗(HFRT):36-45Gy/12-15f]。结果显示,RFA组3年局部复发率为12.9%,放疗组为5.3%;对于肿瘤与血管粘连(≤1mm)的患者,RFA组3年局部复发率为25.5%,放疗组为5.2%(P值均< 0.01)。
关于SBRT和RFA在亚洲HCC人群中的疗效差异,有更大样本量的研究提供了佐证。该研究[12]回顾性分析了2064例患者的数据,其中RFA组1568例,SBRT组496例。
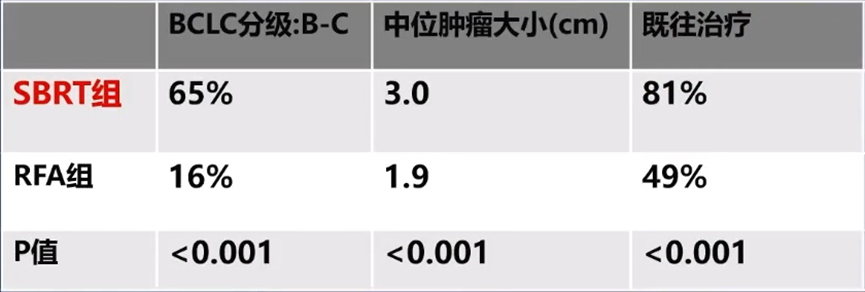
经倾向性评分匹配后,SBRT组2年的局部复发率为16.4%,RFA组为31.1%(P<0.001)。这一结果提示,对于不可手术的HCC患者,SBRT是RFA的有效替代治疗方案,尤其是对于肿瘤直径>3cm,位于膈下和经肝动脉化疗栓塞(TACE)治疗后复发的患者。
放疗在HCC综合治疗中的价值
1 窄切缘手术+术后放疗
尽可能做到宽切缘(≥1cm)是肝癌根治术的目标之一。但是在临床实践中,由于肿瘤靠近肝内大血管分支、肿瘤位于肝中或尾状叶等特殊位置、肝硬化程度重需要尽可能保留功能正常的肝组织等原因,窄切缘(<1cm)手术往往难以避免。而接受窄切缘手术的肝癌患者术后发生复发转移的比例甚高。
为改善这部分患者的预后,王维虎教授团队的一项研究[13]纳入了181例患者,将其分为三组:A组(n=33)窄切缘手术+IMRT、B组(n=83)单纯窄切缘手术和C组(n=65)宽切缘根治术,观察三组的疗效差异。研究发现:对于HCC患者,接受窄切缘手术联合术后放疗可以达到与宽切缘根治术相似的疗效。
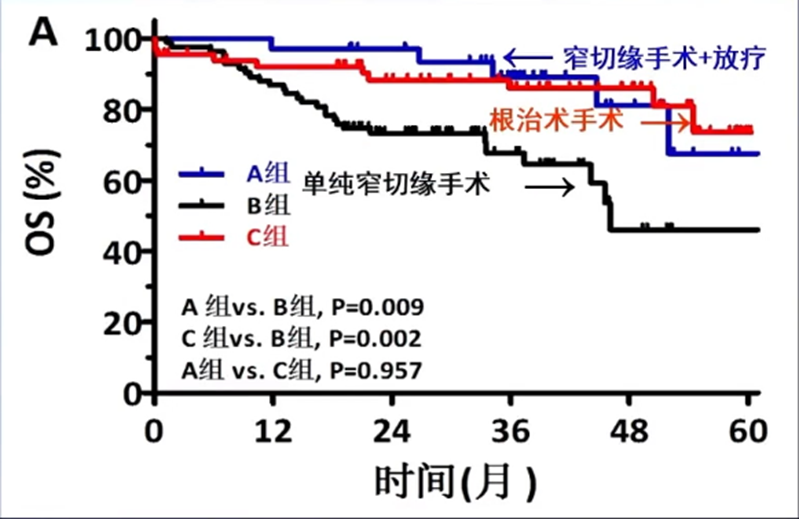
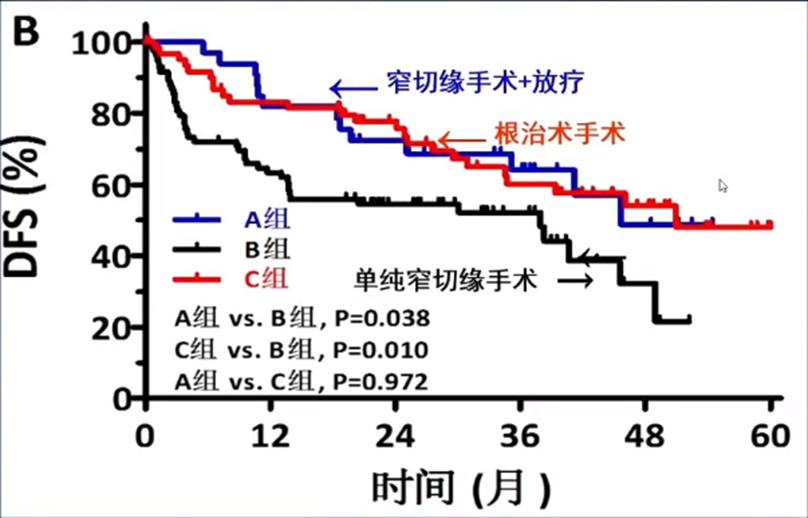
为了对肝癌窄切缘术后放疗的疗效进行进一步验证,王维虎教授团队又设计了一项前瞻性II期研究[14],其结果于2021年发表于Hepatology。该研究纳入了76例患者,入选标准为:肝切除术后病理诊断为HCC;手术切缘<1cm;年龄大于18岁;ECOG评分0分或1分。术后CTV定义为瘤床外放1.0cm、临近大血管区域外放1.5cm。手术到放疗的中位时间为8周(4-12周),采用IMRT技术,中位放疗剂量为60Gy(46-60Gy)。研究结果显示,肝癌窄切缘术联合放疗的5年OS率可达72.2%,且未见RILD,进一步证实了HCC窄切缘手术+术后放疗可以取得与根治性手术相当的疗效。
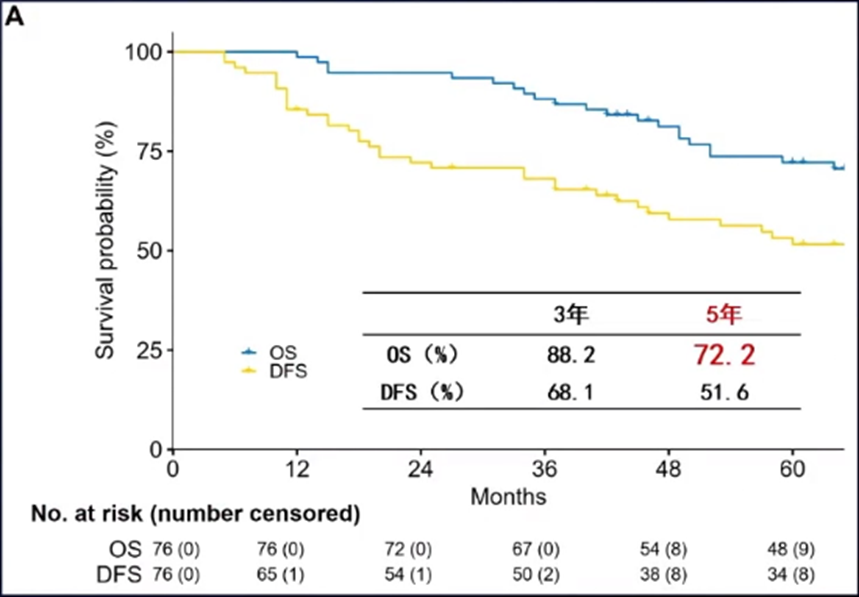
在上述研究的基础上,王维虎教授团队又进一步开展了肝癌窄切缘术后联合/不联合放疗的倾向性评分匹配研究[15]。结果显示,窄切缘手术联合放疗的OS和PFS均显著高于单纯肝癌窄切缘手术。
2 中央型肝癌术前放疗
既往研究显示,仅接受手术的中央型HCC患者,5年OS率仅为37.2%[16]。鉴于这部分患者疗效较差,王维虎教授团队开展了关于中央型HCC术前放疗的前瞻性II期研究[17]。
研究假设,接受新辅助IMRT联合手术的中央型HCC患者,5年OS率可达到与接受根治性手术的巴塞罗那分期(BCLC)0-A期HCC患者的相似水平(北京大学肿瘤医院为67.0%[18])。最小样本量估算为35例,假定脱失率为5%,最终入组38名患者。术前放疗的处方剂量为50-60Gy/25-30f,放疗结束后4-12周进行手术。
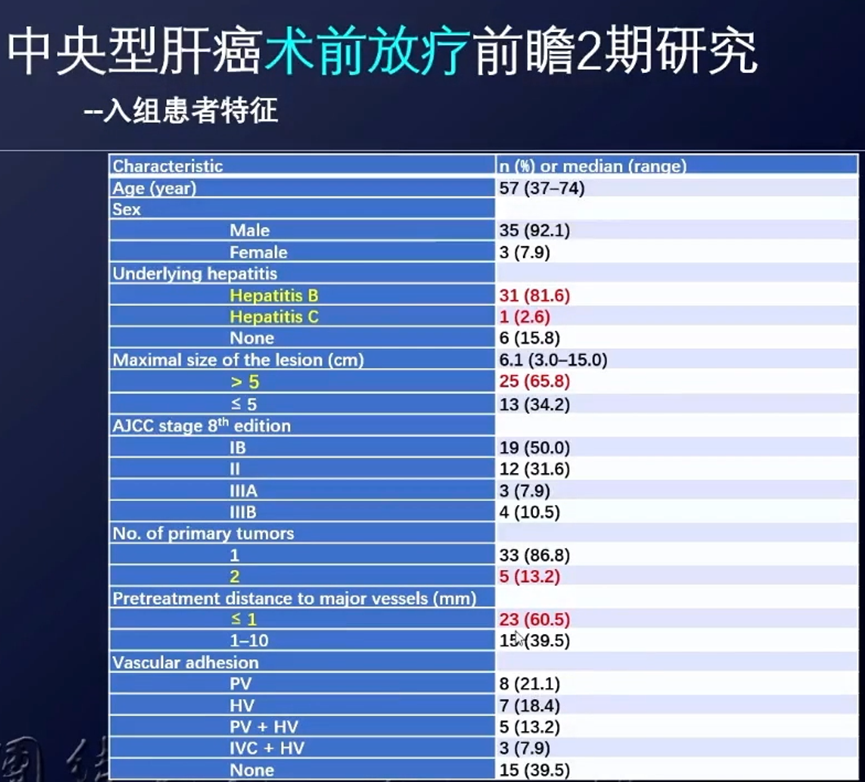
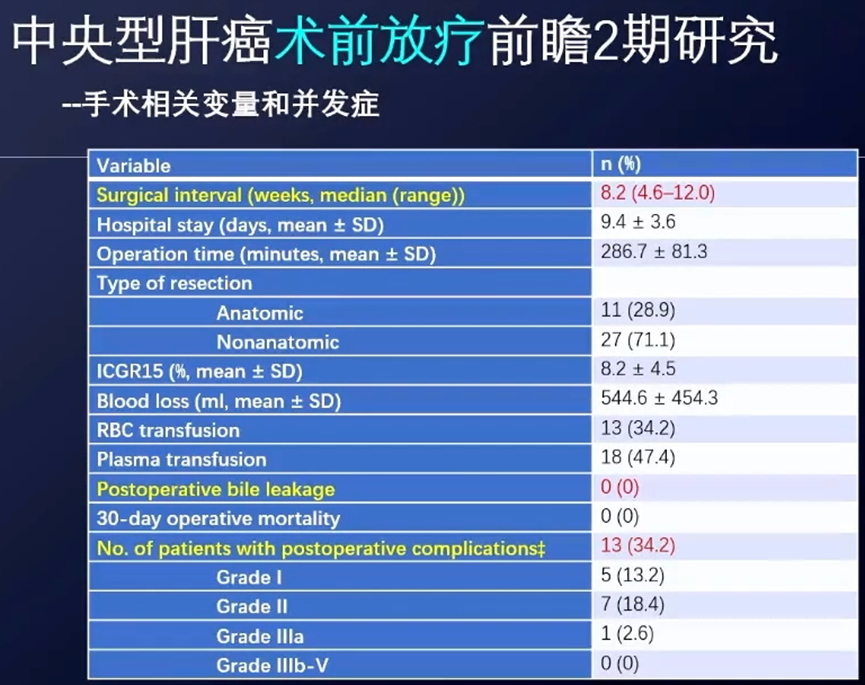
根据Clavien-Dindo分类法,术后并发症发生率为34.2%,主要是I/II级并发症,具体包括:腹水(5例)、发热(4例)、肝功能异常(3例)、胸水(2例)、肺炎(1例)、腹腔感染(1例)、肌酐升高(1例)、凝血障碍(1例)、胃潴留(1例)。
以mRECIST标准评价近期疗效,结果表明:部分缓解(PR)率为42.1%,疾病稳定(SD)率为57.9%,病理学完全缓解(pCR)率为13.2%,主要病理缓解(MPR)率为34.2%。有37例(97.4%)患者手术后取得了阴性切缘。
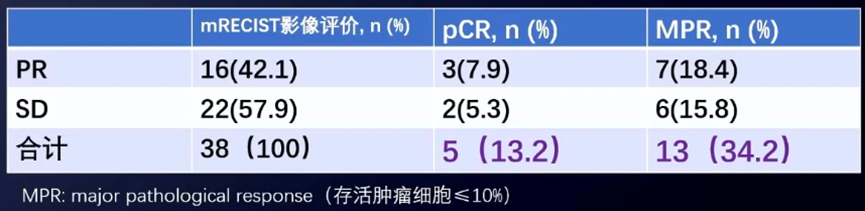
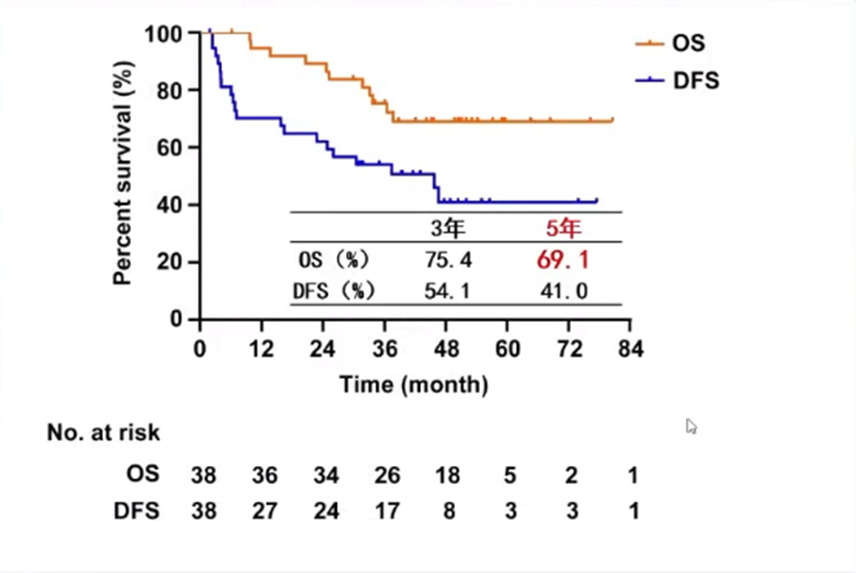
在长期疗效方面,该组患者的5年OS率可达到69.1%。该研究表明,新辅助IMRT联合手术对中央型HCC有效且耐受性良好,为进一步开展III期临床试验奠定了基础。
3 HCC合并瘤栓的术前放疗
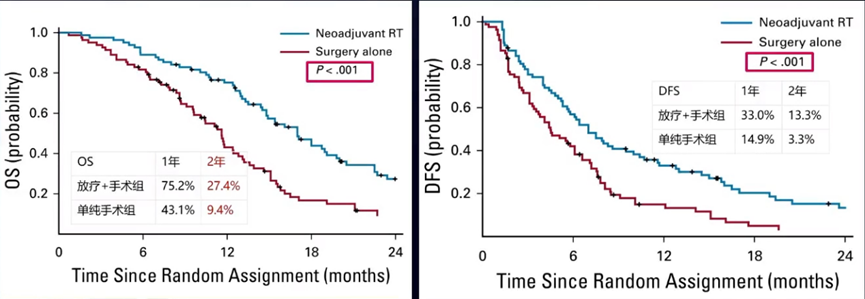
一项研究[19]探索了术前放疗在合并瘤栓HCC患者中的作用。研究纳入了2016年1月-2017年12月合并可切除门脉主干和左右支瘤栓的HCC患者,新辅助放疗组和单纯手术组各82例。放疗采用3D-CRT技术,处方剂量:18Gy/6f。结果证实,接受新辅助放疗患者的疗效显著提高,2年OS率可达27.4%,2年无病生存(DFS)率可达13.3%(P值均<0.001)。
4 局部晚期HCC放疗降期/转化治疗
有研究[20]探索了放疗联合其他治疗手段对局部晚期HCC患者降期的效果。研究纳入了2001年1月-2018年12月1078例局部晚期HCC患者,其中BCLC B期115例、C期963例,病变局限于肝内和区域淋巴结。最常用的治疗模式为同步放化疗(497例患者,46.1%)和TACE联合放疗(251例患者,23.3%)。其中,放疗采用3D-CRT或IMRT技术,处方剂量为45-60Gy/20-25f。放疗联合其他治疗后,12.8%的患者转化为可手术,其中96例(8.9%)接受了手术切除,42例(3.9%)接受了肝移植。对于放疗后转化降期并接受手术的患者,OS和PFS明显优于未接受手术者。
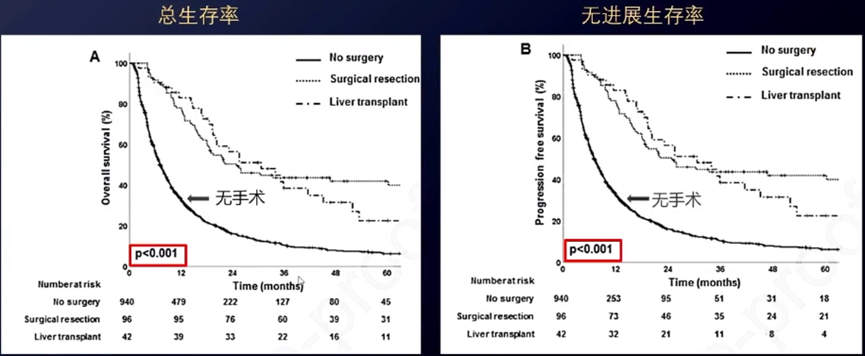
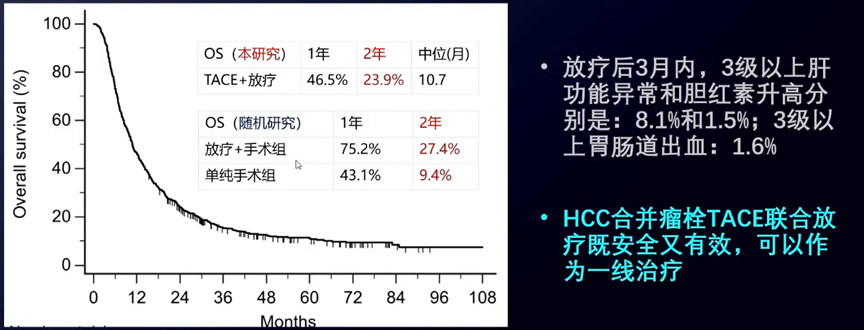
5 TACE联合放疗是合并瘤栓HCC的一线治疗方案
一项韩国研究[21]探索了639例合并瘤栓的HCC患者接受TACE联合放疗的疗效。其中55.2%的患者有主干、双侧门脉或下腔静脉瘤栓,26.4%有肝外转移(淋巴结和肺多见)。97.7%的患者先行TACE后接受放疗。中位放疗剂量为39Gy(24-50Gy),中位单次剂量为2.5Gy(2-5Gy)。研究结果提示,对于合并瘤栓的HCC患者,TACE联合放疗既安全又有效,可以作为一线治疗。
总结
1) 对于小肝癌,SBRT可作为潜在的根治性治疗手段;
2) 近年来,围手术期的放疗在HCC中取得了重要进展,值得进一步开展大规模研究探索术前、术后放疗在HCC中的价值;
3) 放疗在局部晚期HCC患者的综合治疗中有着重要的地位。TACE+精准放疗可作为合并瘤栓HCC的一线治疗方案,另外放疗也有降期、将不可手术/移植患者转化为可手术/移植状态的作用;
4) 有效的全身治疗(如靶向联合免疫)为局部放疗奠定了基础,同时精准放疗强化了全身治疗的局部疗效,且在部分患者中具有远隔效应。强强联手是未来HCC治疗的发展趋势,精准放疗联合靶免治疗值得在HCC中进一步探索。
参考文献
[1] AJR Am J Roentgenol. 2006;186(1):149-157.
[2] Radiology. 2001;219(2):445-454.
[3] Gut. 2010;59(5):638-644.
[4] Radiology. 2012;264(3):761-770.
[5] Int J Radiat Oncol Biol Phys. 2014;89(4):804-813.
[6] Radiat Oncol. 2010;5:73.
[7] Eur J Cancer. 2020;134:41-51.
[8] Radiother Oncol. 2019;131:135-144.
[9] J Med Imaging Radiat Oncol. 2021;65(7):956-968.
[10] Hepatol Int. 2020;14(5):788-797.
[11] Hepatology. 2019;69(6):2533-2545.
[12] J Hepatol. 2020;73(1):121-129.
[13] Liver Int. 2015;35(12):2603-2610.
[14] Hepatology. 2021;74(5):2595-2604.
[15] Radiother Oncol. 2023;180:109462.
[16] J Am Coll Surg. 2014;218(3):381-392.
[17] JAMA Surg. 2022;157(12):1089-1096.
[18] 中华医学杂志. 2015;95(22):1747-1750.
[19] J Clin Oncol. 2019;37(24):2141-2151.
[20] Radiother Oncol. 2020;152:1-7.
[21] Radiother Oncol. 2019;141:95-100.


