【衡道丨干货】2024版CSCO头颈部肿瘤指南更新
时间:2025-02-16 12:09:30 热度:37.1℃ 作者:网络
头颈部肿瘤是常见的恶性肿瘤之一,在我国男性中的发生率为第6位,死亡率为第7位。最常见的病理类型为鳞癌,除了鼻咽癌主要由EB病毒引起,烟草和酒精是导致其他头颈部鳞癌的主要原因。近年来,欧美国家口咽癌的发病率明显上升,研究提示大部分与HPV感染具有直接关系。虽然我国的具体感染率尚不明确,但同样有逐年升高的趋势。基于一项针对HPV-16检测的meta分析,国内头颈部肿瘤的HPV总体感染率为24.7%,中部地区和口咽癌的比例分别为37.0%和31.6%。
近期一项基于WHO数据库的研究显示,中国HPV阳性口咽癌的比例为25.8%,而BROADEN-China的大样本观察性研究正在进行中。基于不同地区,唾液腺癌占头颈部肿瘤的4.0%~14.3%,主要发生于大唾液腺(腮腺、下颌下腺和舌下腺)和小唾液腺。
头颈部鳞癌的原发灶诊断主要依赖经口或内镜下肿块活检,而淋巴结穿刺或活检有助于分期诊断。由于下咽癌有较高的食管累及或食管癌第二原发,建议分期检查时常规行食管胃十二指肠镜(esophagogastroduodenoscopy,EGD)检查。唾液腺癌的原发灶诊断在国内大多依赖切除活检或术中冰冻检查,在有条件的医院建议采用术前肿块细针穿刺或粗针活检,并遵循行业标准的诊断报告体系,有助于在治疗前确定组织学分类和分级,从而指导后续处理策略。
头颈部肿瘤病理学诊断
所有手术标本(形态学):
(一)Ⅰ级推荐:
根据组织形态学明确鳞癌和其他类型头颈部肿瘤
根治性手术标本(形态学):
(一)Ⅰ级推荐:
原发灶部位、大小、组织学类型及分级、有无神经及脉管侵犯
原发肿瘤侵袭深度(针对口腔癌)切缘有无肿瘤、上皮中或重度异常增生淋巴结转移及淋巴结包膜外侵状态
头颈部鳞癌(辅助检查)
(一)Ⅰ级推荐:
根据免疫组化染色结果明确头颈部鳞癌和其他类型头颈部肿瘤
p16免疫组化检测以确定与HPV感染相关(针对口咽癌)
PD-L1免疫组化检测(针对复发转移性癌)
(二)Ⅱ级推荐:
HPV DNA或RNA检测(针对口咽癌)
鼻咽癌(辅助检查)
(一)Ⅰ级推荐:
根据免疫组化染色结果明确鼻咽癌和其他类型头颈部肿瘤
EBER原位杂交检测以确定与EBV感染有关
(二)Ⅱ级推荐:
EGFR免疫组化检测
唾液腺癌(辅助检查)
(一)Ⅰ级推荐:
根据免疫组化染色结果明确唾液腺癌和其他类型头颈部肿瘤
(二)Ⅱ级推荐:
AR和HER2免疫组化检测(针对唾液腺导管癌)
NTRK荧光原位杂交检测(针对分泌性癌)
EBER原位杂交检测(针对淋巴上皮癌)
MYB荧光原位杂交检测(针对腺样囊性癌)
MAML2荧光原位杂交检测(针对黏液表皮样癌)
PLAG1荧光原位杂交检测(针对癌在多形性腺瘤中)
(三)Ⅲ级推荐:
二代基因测序
鼻腔和鼻窦癌(辅助检查)
(一)Ⅰ级推荐:
根据免疫组化染色结果明确鼻腔鼻窦癌和其他类型头颈部肿瘤
(二)Ⅱ级推荐:
NUT免疫组化检测(针对NUT癌)
头颈部肿瘤的病理对于分期诊断和治疗选择至关重要。无论是活检或穿刺标本,首先需要根据组织形态学确定良恶性及组织学类型,必要时结合免疫组化染色结果。对于头颈部鳞癌的根治性手术标本,除了进行巨检和镜下描述,还需要提供肿瘤大小、分化程度、切缘、脉管侵犯、周围神经浸润、骨或软骨浸润、淋巴结转移部位和数目,以及包膜外侵犯等信息。对于口腔癌,需要明确肿瘤侵袭深度,从而有利于确定原发灶分期和指导后续治疗策略。对于口咽癌,应进行p16的免疫组化检测作为替代指标以明确是否与HPV感染相关,美国临床肿瘤学会(ASCO)和美国病理协会均推荐采用≥70%的中等或强阳性(肿瘤细胞)作为诊断标准,有条件的中心可以进行HPV DNA或RNA检测。虽然HPV感染是口咽癌的分期和预后判断的重要因素,但目前各指南尚不建议根据检测结果决定后续个体化的治疗策略。对于复发转移性头颈部鳞癌,在考虑一线免疫治疗选择时可进行PD-L1免疫组化检测,推荐采用综合阳性评分(combined positive score,CPS)。对于鼻咽癌,特别是非角化型,应进行EBER原位杂交检测以明确是否与EBV感染相关。在某些决定EGFR单抗的使用指征时,可进行EGFR免疫组化检测。
对于唾液腺癌,确定肿瘤的恶性程度对于判断预后和指导后续治疗策略非常重要,表1列举了WHO的组织学分类和分级的主要类型。对于唾液腺导管癌,进行雄激素受体(AR)和HER2的免疫组化检测有助于确定针对性的靶向治疗,后者的诊断标准可以参照针对乳腺癌的相关指南。对于分泌性癌,通过NTRK荧光原位杂交检测(特别是ETV6-NTRK3基因融合)不但能够与腺泡细胞癌进行鉴别诊断,并且有助于确定TRK抑制剂的靶向治疗。此外,通过EBER原位杂交以及MYB、MAML2和PLAG1的荧光原位杂交有助于分别诊断淋巴上皮癌、腺样囊性癌、黏液表皮样癌和癌在多形性腺瘤中。鉴于分子检测在唾液腺癌诊断和治疗中的价值,推荐有条件的患者进行二代基因测序。
表1 唾液腺癌的组织学分类和分级
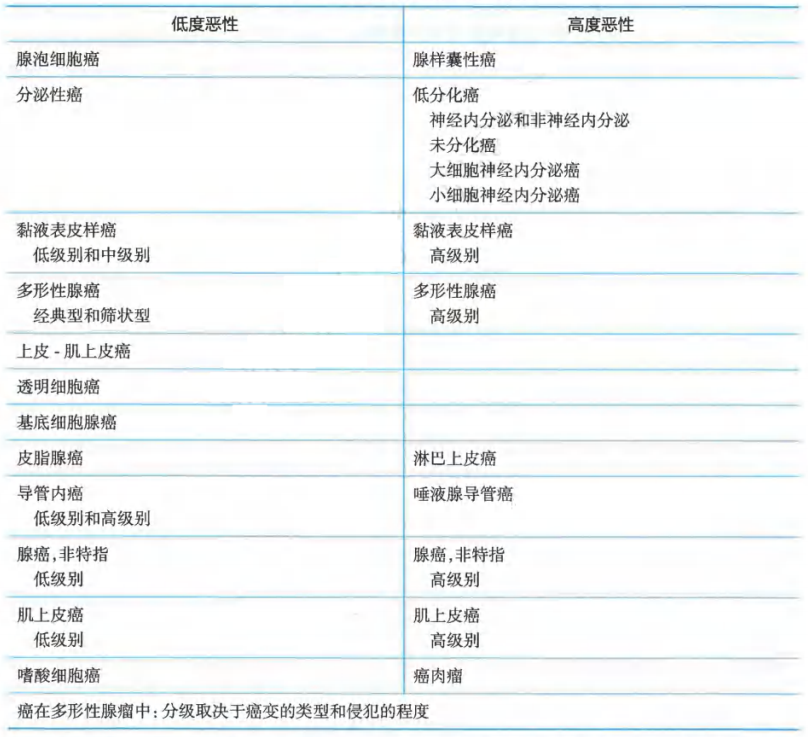
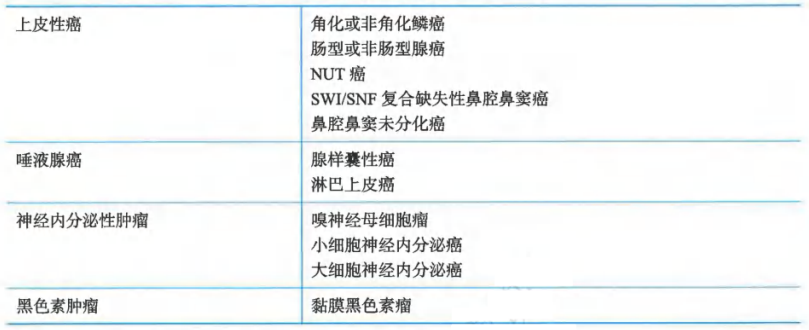
对于鼻腔和鼻窦癌,确定组织学类型对于指导治疗策略具有重要价值,表2列举了主要的组织学分类。NUT癌是一类好发于中线器官的罕见类型(又称NUT中线癌),鼻旁窦是最常见的累及部位,既往容易被误诊为低分化或未分化癌。NUT癌预后极为凶险,通常具有NUTM1基因的重排,通过NUT免疫组化有助于确定诊断,为可能的靶向治疗创造条件。SWI/SNF复合缺失性鼻腔、鼻窦癌主要涉及SMARCB1和SMARCA4这2个基因,这类肿瘤同样进展迅速并缺乏有效的治疗药物,对于复发转移的患者应推荐参加临床试验。
表2 鼻腔和鼻窦癌的主要组织学类型
头颈部鳞状细胞癌PD-L1表达临床病理检测中国专家共识(2024版)
程序性死亡配体1(PD-L1)表达水平是头颈部鳞状细胞癌(HNSCC)患者免疫治疗方案选择的关键指标。HNSCC中PD-L1表达检测在抗体克隆号、检测平台、评分方法、结果判读及临床阳性阈值等方面与其他瘤种存在不同。为规范HNSCC中PD-L1表达检测流程、判读标准等,解决临床实践中常见问题,经由中华医学会病理学分会牵头组织头颈疾病学组及相关临床肿瘤专家多次会议讨论并对共识意见进行投票,最终形成本专家共识,旨在更好地指导HNSCC中PD-L1表达临床病理检测。本共识内容基于现有证据,将来可依据新的证据进行相应更新。
共识意见1:PD-L1表达检测在HNSCC患者选择免疫治疗方案中起着重要作用,PD-L1表达水平越高,患者越有可能从免疫治疗中获益(推荐级别:强推荐)。
共识意见2:对所有计划接受免疫检查点抑制剂治疗的HNSCC患者,推荐治疗前检测PD-L1表达(推荐级别:强推荐)。
共识意见3:中国HNSCC针对PD-1/PD-L1获批药物为帕博利珠和纳武利尤单抗。不同克隆号抗体应采用相应检测平台,如克隆号22C3抗体对应药物为帕博利珠单抗,克隆号28-8抗体对应药物为纳武利尤单抗,两种抗体均使用Dako AutoStainer Link 48检测平台(推荐级别:强推荐)。
共识意见4:使用3.7%的中性甲醛液固定标本6~72 h。使用保存时间为2年内的石蜡包埋组织进行检测,已切好的白片需在2个月内(室温保存)或4个月内(2~8 ℃保存)完成检测(推荐级别:强推荐)。
共识意见5:样本中活性浸润性肿瘤细胞超过100个的粗针穿刺、活检及手术标本均可用于PD-L1表达检测,细胞学涂片及经含盐酸、硝酸等强酸脱钙处理的标本不适合用于PD-L1表达检测(推荐级别:强推荐)。
共识意见6:CPS判读时,需综合评判肿瘤细胞和肿瘤相关炎性细胞(淋巴细胞及巨噬细胞)的PD-L1表达水平,肿瘤相关炎性细胞的范围界定采用20×法则,CPS报告数值为0~100间的整数,如果有表达,但计算结果<1,则报告为CPS<1(推荐级别:强推荐)。
共识意见7:免疫组织化学切片中可能无法准确区分淋巴细胞、巨噬细胞和其他炎性细胞,推荐PD-L1表达检测时对蜡块作连续切片,同时行HE染色,帮助区分不同种类的炎性细胞(推荐级别:推荐)。
共识意见8:HNSCC中PD-L1表达CPS判读时需评估整张切片,而非热点区(推荐级别:强推荐)。
共识意见9:TPS判读仅评估浸润性肿瘤细胞PD-L1表达情况,结果以百分数表示(推荐级别:强推荐)。
共识意见10:CPS和TPS判读人员须参加相关培训,获得判读资质证书或科室判读授权后方可进行结果判读。对于处于阈值附近的病例,建议3位及以上的医师共同参与读片确定最终结果(推荐级别:推荐)。
共识意见11:国内外研究数据显示PD-L1表达CPS分布较为一致,1≤CPS<20和CPS≥20病例所占比例均为40%左右,各检测机构可参考该数据分布,自我评估PD-L1检测和CPS评分是否存在质控风险(推荐级别:强推荐)。
共识意见12:如果有多个肿瘤组织蜡块,应择取最具代表性的蜡块进行PD-L1蛋白表达检测。由于肿瘤内部PD-L1蛋白表达具有空间异质性,推荐临床检测时尽量采用手术切除组织,如仅有穿刺或活检标本时,应尽可能采用多块组织行PD-L1表达检测(推荐级别:推荐)。
共识意见13:原发和复发HNSCC样本PD-L1表达存在差异,在临床可及条件下,推荐同时检测原发和复发肿瘤样本(推荐级别:弱推荐)。
共识意见14:对于发生转移的肿瘤,根据临床样本可及性选择用于PD-L1检测的标本,优先选择原发灶肿瘤组织,有条件时亦可对原发灶和转移灶均进行检测,淋巴结转移灶的评估需同时提供CPS和TPS结果(推荐级别:推荐)。
共识意见15:不同克隆号抗体检测HNSCC中PD-L1表达一致性的研究结果存在争议,尚缺乏大样本的前瞻性研究,采用除22C3和28-8之外的其他克隆号抗体检测HNSCC中PD-L1表达时,检测报告中需注明抗体克隆号和检测平台,并分别提供肿瘤的TPS和CPS评分结果(推荐级别:推荐)。
共识意见16:进行PD-L1免疫组织化学染色时,需在切片上同时设置内部阳性对照组织和内部阴性对照组织,与待检组织一同染色,待检组织需另切一张切片进行阴性对照试剂染色(强推荐)。
共识意见17:严格按顺序评估内部阳性对照组织、内部阴性对照组织、阴性对照试剂染色和待检组织的染色情况,任何对照组织或待检组织出现非预期结果时,需重新设置完整的对照完成一次新的染色后再行评估(推荐级别:强推荐)。
共识意见18:因样品固定不佳、切片上组织卷曲、刀痕及白片保存不当等原因造成非特异染色或异常染色时,应重新选取蜡块或重新切片行PD-L1免疫组织化学染色后再评估(推荐级别:强推荐)。
共识意见19:建立规范化的PD-L1检测操作流程,进行性能验证,定期开展室内质控和室间质控(推荐级别:推荐)。
共识意见20:临床病理科、有资质的检测机构等需验证LDT与伴随诊断试剂盒的一致性,并在严格方法验证和质量控制前提下根据自身情况谨慎开展PD-L1表达LDT检测(推荐级别:推荐)。
共识意见21:PD-L1免疫组织化学检测报告中需包含表格中的所有信息,具体报告格式可根据各单位情况自行拟定(推荐级别:推荐)。
头颈部鳞状细胞癌中PD-L1表达检测报告模板

参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.《头颈部鳞状细胞癌PD-L1表达临床病理检测中国专家共识(2024版)》


