免疫介导性帕金森|疑难探究
时间:2025-01-13 12:19:42 热度:37.1℃ 作者:网络
导读:免疫介导性帕金森综合征(immune-mediated parkinsonism)是临床上较为少见的免疫介导性运动障碍疾病,其病因不明,可能与感染、肿瘤等继发性自身免疫机制紊乱有关,通常与Ma2(或Ma1与Ma2共存)、富亮氨酸胶质瘤失活1蛋白(leucine-richglioma inactivated1,LGI1)、ANNA-2及GAD65等自身抗体相关,部分患者合并睾丸肿瘤、扁桃体鳞状细胞癌、B细胞淋巴瘤、胰腺癌、肾癌及肺癌等。
免疫介导性运动障碍疾病(immune-mediated movement disorders)泛指一类由自身免疫机制介导的运动障碍疾病,包括运动过多(如舞蹈症、肌阵挛、抽动症)、运动减少(如帕金森综合征)和共济失调等症候群。神经自身抗原所产生的异常免疫反应而引发的以运动障碍为主要表现的一大组不同的神经疾病群组,临床并非罕见,国外报道约占运动障碍的7%-8%。我国学者总结一组自身免疫性脑炎患者临床症状,发现运动障碍占52.2%。运动障碍潜在的机制可能为副肿瘤性、类感染性及特发性。这组疾病通常为急性或亚急性起病,成人和儿童均可患病,运动症状可单独出现,但常伴有癫痫、认知障碍、意识障碍等神经精神症状。其运动障碍表现多样,几乎可涵盖所有的症状类型:包括运动过多综合征,如舞蹈症、肌阵挛、肌张力障碍和抽搐;运动减少综合征,如帕金森综合征、紧张症和共济失调等;部分疾病呈现混合型运动障碍,既可表现运动过多又可表现运动减少。病程可长达数周致数月。多数患者可在血清或脑脊液中检出抗神经元IgG抗体,在血清或脑脊液中能找到相关抗神经自身抗体是该类疾病最共同的特征,每种自身抗体均有其较为相对特定的运动障碍。早期免疫治疗效果良好,且能帮助发现相关隐匿性肿瘤,因此准确诊断免疫机制介导的运动障碍对及时诊治至关重要。
帕金森综合征是一种由多种原因引起的临床综合征,主要表现为运动迟缓、僵硬、静止性震颤和姿势不稳等。常见的疾病发展模式为隐匿起病、逐渐进展、极少自然缓解。但临床上有一些帕金森综合征患者病情会发生好转、自然缓解或“治愈”,被称为可逆性帕金森综合征(RP)。
而帕金森病(PD)大多数是散发性的,其病因是复杂的,并且在很大程度上仍然未知。在病理学上,PD的表现与特定脑区、脊髓和外周神经中的多巴胺能(DA)神经元的广泛退化有关。这些退化性变化主要在中脑黑质致密部(SNc)观察到。最近人们认识到,包含称为α-突触核蛋白的错误折叠蛋白聚集的路易体伴随着受影响区域的神经元损失。在过去曾经提出几个关于PD中多巴胺能神经元变性机制的假说,其中氧化应激、兴奋毒性机制和环境因素可能起作用。然而,缺乏基于这些机制的疾病缓解治疗需要进一步探索这种疾病的潜在原因。
近年来PD中神经炎症的证据引起了广泛关注。PD一个关键特征是错误折叠的α-突触核蛋白的积累,在黑质致密部形成不溶性路易体,这有助于神经变性。这些α-突触核蛋白聚集物可能作为自身抗原,导致T细胞介导的神经炎症并导致多巴胺能细胞死亡。来自PD患者的t细胞似乎具有启动针对α-突触核蛋白及其修饰肽的自身免疫反应的潜力,可能导致新表位的形成。最近的证据表明,PD与异常免疫反应有关,如在患者和小鼠模型中观察到的免疫细胞水平增加,如CD4+和CD8+ T细胞。T细胞滤过的聚集增加了主要组织相容性复合体分子,多巴胺能神经元的易感性支持了帕金森病可能表现出自身免疫特征的假说。
这些证据包括脑脊液和血液中促炎细胞因子的增加,SNc中活化的小胶质细胞和巨噬细胞的检测,受影响脑区中T淋巴细胞的浸润,以及PD患者中T和B淋巴细胞活性的改变。最近发现Toll样受体(TLRs)可能是帕金森病中重要的免疫受体,通过它可以引发神经炎症。其中有认为自噬功能障碍是参与PD的关键机制之一,导致α-突触核蛋白等蛋白质的异常降解和聚集。Parkin编码基因突变是早发性帕金森病的常见原因。研究也揭示了PD患者中α-突触核蛋白反应性T细胞的存在及其与临床前和早期PD反应性的相关性,表明PD与自身免疫有关。
长期以来已经观察到PD风险与自身免疫性疾病相关。瑞典的一项流行病学研究表明,患有6种自身免疫性疾病,包括肌萎缩侧索硬化、格雷夫斯病/甲状腺功能亢进、桥本氏病/甲状腺机能减退、多发性硬化、恶性贫血和风湿性多肌痛的患者随后发生PD的风险增加,而PD风险与多发性硬化之间的因果关系仍有争议。
曾经认为自身的神经元会免受自身的免疫攻击。然而,一项研究中已证实受到帕金森病影响的多巴胺能神经元是比较脆弱的,这是因为它们在其细胞表面上含有被免疫系统识别为外源物质的蛋白,引起T细胞反应——在自身免疫情况下属于不当反应。因此认为T细胞有潜力将被PD破坏的神经元错误地识别为外来入侵者。2017年Nature期刊发表的T cells from patients with Parkinson’s disease recognize α-synuclein peptides研究报告PD的一种可能的自身免疫特征,这些发现或许能为PD的成因带来新的启发。
PD和自身免疫性疾病之间存在共同的遗传风险变异。比如CLEC16A与帕金森病致病机制的功能重叠及其与自身免疫性疾病的广泛关联。CLEC16A是一种参与调节自噬和抗原呈递的膜相关内体蛋白。其遗传变异与多种自身免疫性疾病广泛相关。长期以来,临床上观察到经历自噬破坏和神经炎症的PD与自身免疫性疾病有关,免疫紊乱越来越被认为是PD发病机制中的重要因素。
α-突触核蛋白在神经细胞中聚集是帕金森病的一种特征,帕金森病也与蛋白质加工缺陷有关。理论上,蛋白质加工异常会导致反常蛋白片段的产生和呈现,这些片段会被T细胞识别出来,并导致T细胞激活。一项研究比较了来自67位PD患者和对照组36位健康人的样本,发现PD患者的T细胞能识别出一系列α-突触核蛋白产生的肽,但健康人不能。
新研究增加了越来越多的证据表明PD部分是一种自身免疫性疾病。Nature medicine期刊报道肿瘤免疫疗法可能引起PD,发现靶向于BCMA的CAR-T细胞疗法可导致帕金森综合征。事实上,PD患者在被正式诊断前几年就会出现自身免疫的迹象。
2020年一项研究发表在Nature Communications期刊上的研究发现阐明了T细胞反应性和疾病进展的时间线。研究人员观察了一大群PD患者的血液样本,并将他们的T细胞与健康、年龄匹配的对照组进行了比较。研究发现对α-突触蛋白有反应的T细胞在患者首次被诊断出患有该疾病时最为丰富。这些T细胞往往随着疾病的发展而消失,很少有病人在诊断后十年仍有这些细胞。研究还对一名PD患者进行了深入分析,该患者的血液样本恰好可以追溯到其诊断前很久。这个研究显示该患者在被诊断为PD的十年前就对α-突触蛋白有强烈的T细胞反应。同样,这些T细胞在诊断后的几年里逐渐消失了。
在npj Parkinson's Disease期刊发表的一项研究发现,一些PD患者的记忆T细胞具有非常特殊的基因特征,有些基因在靶向α-突触核蛋白中有关键作用,并且可能会造成持续性的炎症发生,进一步导致疾病恶化。研究在收集到PD患者的血液后,按照T细胞是否对α突触核蛋白存在反应,将样本分成了两组。随后,他们在两类血液样本中分别检验了各种免疫细胞的基因表达谱,结果在记忆T细胞中,两组样本的差异基因表达数量显著增多。
2021年在Neurol Neuroimmunol Neuroinflamm期刊上报道的抗Sez6l2(seizure-related 6 homolog like 2)抗体脑炎即是近年关注的一个热点。该研究对4例抗Sez6l2抗体脑炎患者的人口学和临床特征进行总结。所有患者年龄均为>50岁(54-69岁),其中2例为女性,表现为帕金森综合征。所有患者对免疫治疗效果欠佳,病程发展数月后趋于稳定,似乎比细胞表面抗体相关的自身免疫性脑炎的预后较差,可能是由于小脑中浦肯野细胞的丢失。
2022年发表在Front Genet期刊上来自中国的一项队列研究表明,在中国汉族人群中,与自身免疫性疾病相关的CLEC16A变异携带PD风险。PD和自身免疫性疾病之间风险关联的临床观察表明,两者之间可能存在共同的遗传风险位点。通过研究中国队列中五种自身免疫性疾病相关的CLEC16A变异体,研究证明CLEC16A在调节PD风险方面具有多效性,两个位点rs6498169和rs7200786与PD易感性隐性相关。这些发现表明,自身免疫反应可能是帕金森病的背后成因,或许也能解释PD与MHC基因变异的关系。
接触蛋白相关蛋白-2(contactin associated protein-like 2,CASPR2)及富含亮氨酸的神经胶质瘤失活蛋白-1(leucin-rich glioma-inactivated 1 protein,LGI1)是神经元电压门控钾通道(voltage-gated potassium channel,VGKC)复合体自身抗体的主要靶抗原。在皮质下结构中,CASPR2蛋白在背侧丘脑,尾状核,壳核和杏仁核中广泛表达,其在基底节的表达解释了自身免疫性帕金森综合征的发病机理。在临床中,帕金森综合征一般提示退行性疾病,如多系统萎缩,但CASPR2相关自身免疫性帕金森综合征是不同于其他神经退行性疾病的可治疗疾病。
自身免疫性帕金森综合征是具有神经元特异性抗体的帕金森综合征,部分可有CSF异常,其对免疫治疗有显著反应。帕金森综合征的诊断主要是临床诊断,明确诊断需要依靠组织病理学。当有以下情况出现时,结合临床症状可考虑自身免疫性帕金森综合征的诊断:
-
神经元抗体的存在;
-
40%可有炎性脑脊液改变:细胞数和蛋白质可正常或轻度升高(据报道细胞数可正常或轻度增高,可达28×10^6/L;蛋白质可正常或轻度升高,可为0.475-1.175g/L不等);
-
对免疫治疗的即时和显著反应;
-
非运动症状的改善;
-
早期停用类固醇症状再现,重新应用类固醇后症状显著改善。
大部分自身免疫性疾病导致的帕金森综合征在消除病因后症状可以部分甚至完全改善,即所谓的“可逆性”。自身免疫性帕金森综合征抗体检测可在以下种临床情况下需考虑:
-
急性或亚急性发病的运动障碍,快速进展或波动病程患者(非绝对);
-
合并其他中枢神经系统或周围神经系统临床表现,如小脑共济失调,边缘性脑炎等(在这种情况下,需注意合并抗体可能);
-
自身免疫病个人史/家族史、肿瘤病史/肿瘤免疫治疗史、肿瘤风险因素、近期难以解释的体重下降、近期疫苗接种史、病毒感染前驱症状(发热、恶性、呕吐、乏力);
-
其他辅助检查支持免疫性帕金森综合征,如合并自身免疫病的血清学证据、脑脊液免疫炎性证据(细胞学、寡克隆带、IgG指数)、脑电图癫痫波、磁共振免疫炎性表现等。
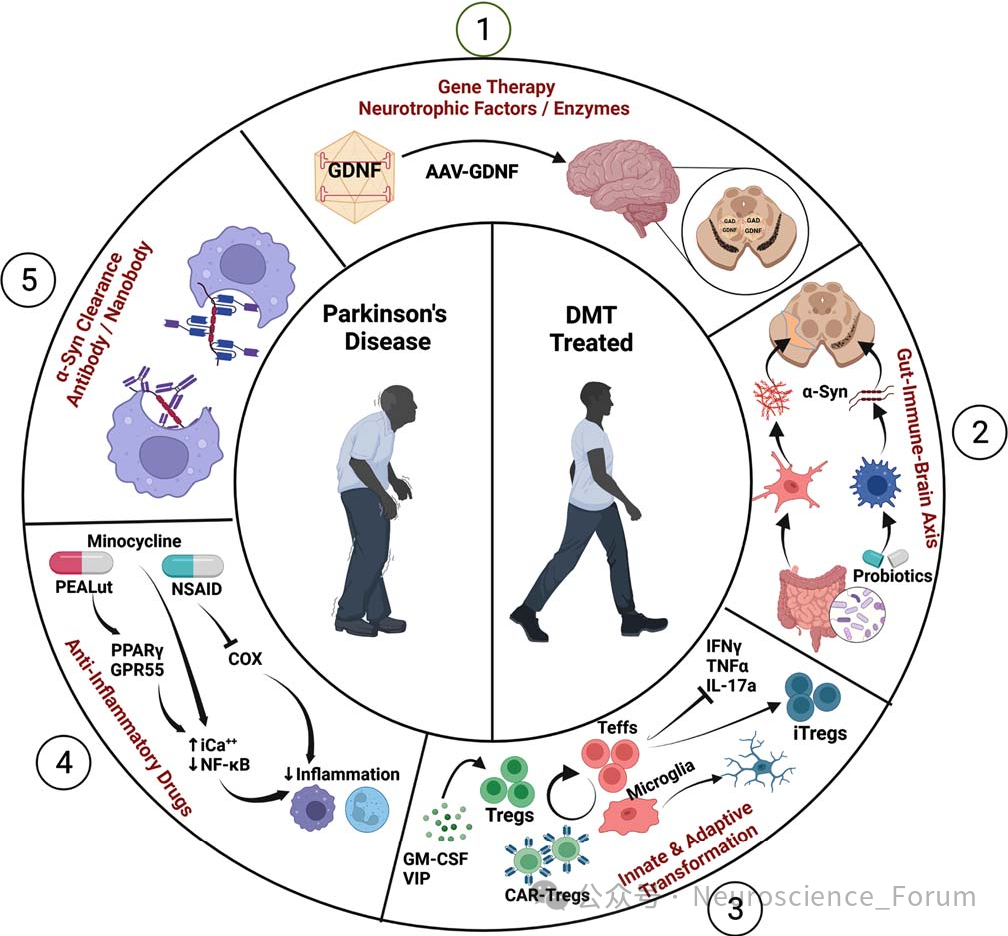
综上所述,免疫系统越来越被认为是帕金森病(PD)发病的主要原因。免疫系统的双刃性给利用免疫调节疗法来预防和减缓这种使人衰弱的疾病的进展带来了问题。为了解决这个难题,理解免疫介导的神经元死亡的机制将有助于确定保护多巴胺能神经元的神经保护策略。特异性先天和适应性免疫介质可能直接或间接诱导多巴胺能神经元死亡。遗传因素、肠脑轴和最近对PD特异性T细胞的鉴定可能为PD发病机制提供了新的机制见解。未来的研究将解决自身抗体鉴定、免疫表型研究的可变性以及肠道生态失调对帕金森病的影响方面的空白,最终可能为帕金森病提供新的治疗靶点。


