华中科技大学李子福教授/杨祥良教授团队Biomaterials:线粒体干扰策略协同光动力治疗用于激活抗肿瘤免疫
时间:2025-01-13 12:14:50 热度:37.1℃ 作者:网络
【研究背景】
针对三阴性乳腺癌(TNBC)的免疫疗法前景广阔,但仍然面临肿瘤免疫原性较低和免疫抑制微环境等挑战。基于免疫原性细胞死亡(ICD)和PD-L1/PD-1阻断的策略有望克服以上问题,但依然面临着制备复杂,成本昂贵和疗效有限等问题。如何通过简单的制备手段构建能够有效克服TNBC复杂肿瘤微环境的纳米药物对于增强TNBC免疫治疗具有重要意义。

针对以上问题,华中科技大学李子福教授/杨祥良教授团队采用一锅法简单地在水中制备了铜-二乙基二硫代氨基甲酸酯/吲哚菁绿纳米颗粒(CuET/ICG NPs),旨在同时增强肿瘤免疫原性和下调程序性细胞死亡配体1(PD-L1),以激活针对TNBC的抗肿瘤反应。相关工作以“A mitochondria-interfering nanocomplex cooperates with photodynamic therapy to boost antitumor immunity”为题发表于Biomaterials杂志。
【文章要点】
如图1所示,在本工作中,作者首先通过正交实验优化了投料比和温度等制备条件,制备出粒径小而均一的CuET/ICG NPs。通过分子动力学模拟和XPS等手段探究了CuET/ICG NPs配位驱动组装的机理。
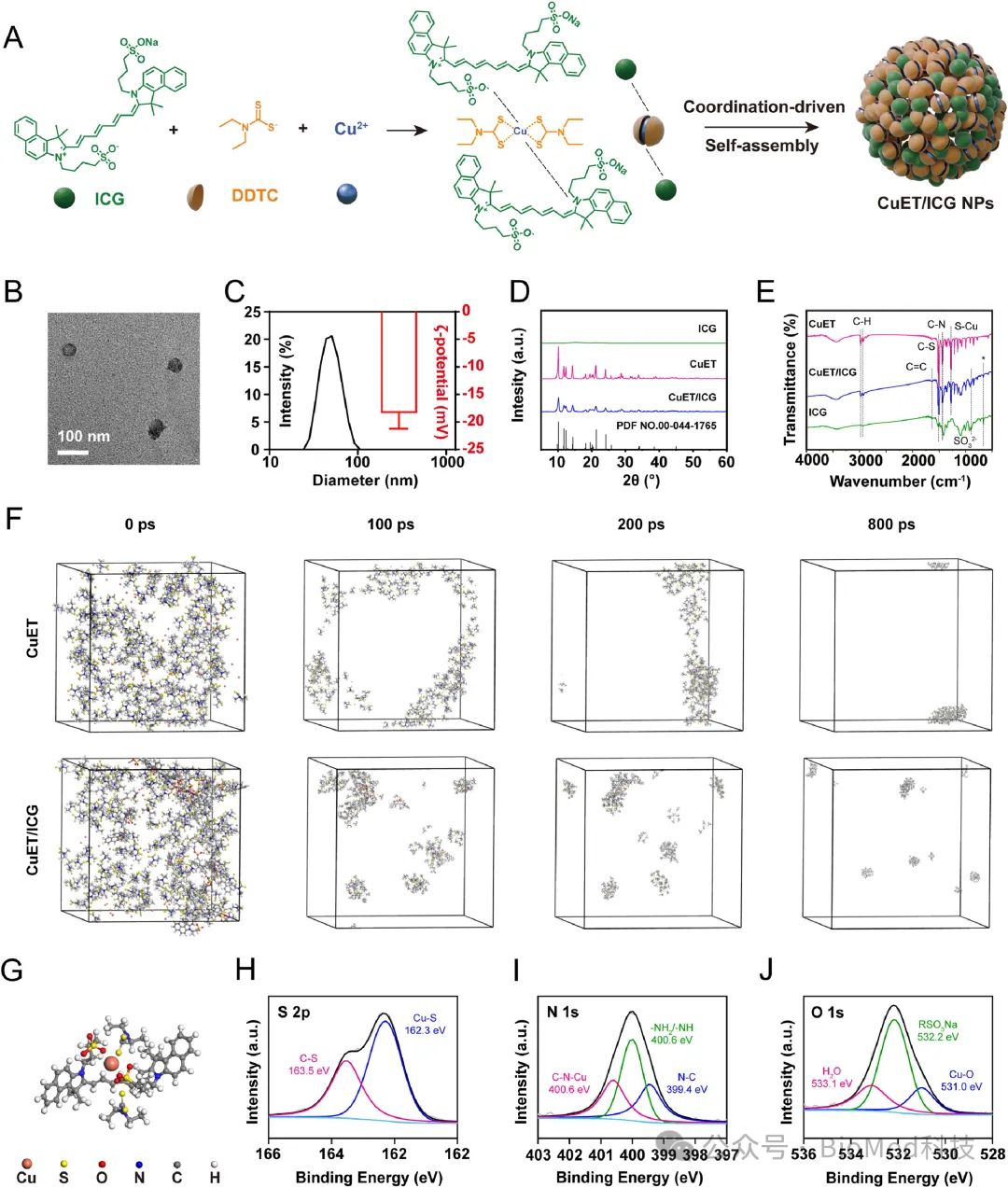
图1.CuET/ICG NPs的制备和表征。
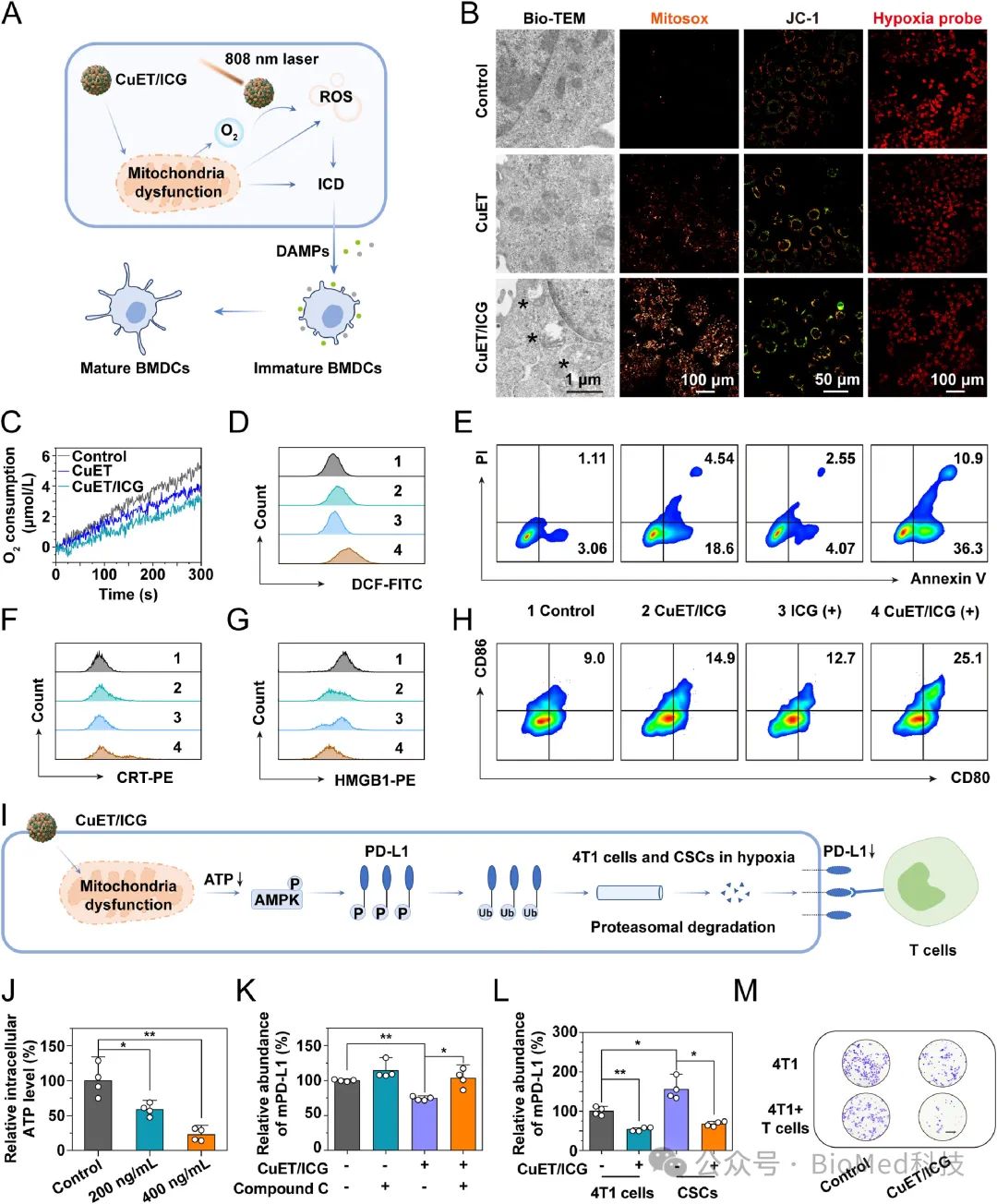
图2. CuET/ICG NPs协同增效PDT和下调PD-L1的相关机理。
如图2所示,在乏氧环境中,CuET/ICG NPs能够通过破坏4T1细胞线粒体的结构和功能,抑制线粒体呼吸和耗氧,改善肿瘤乏氧,增强光动力的ROS产量和提高ICD的诱导效果。此外,通过线粒体干扰降低4T1细胞的ATP水平,CuET/ICG NPs激活了AMPK通路,诱导4T1细胞和CSCs上PD-L1的下调,削弱其介导的免疫逃逸能力。
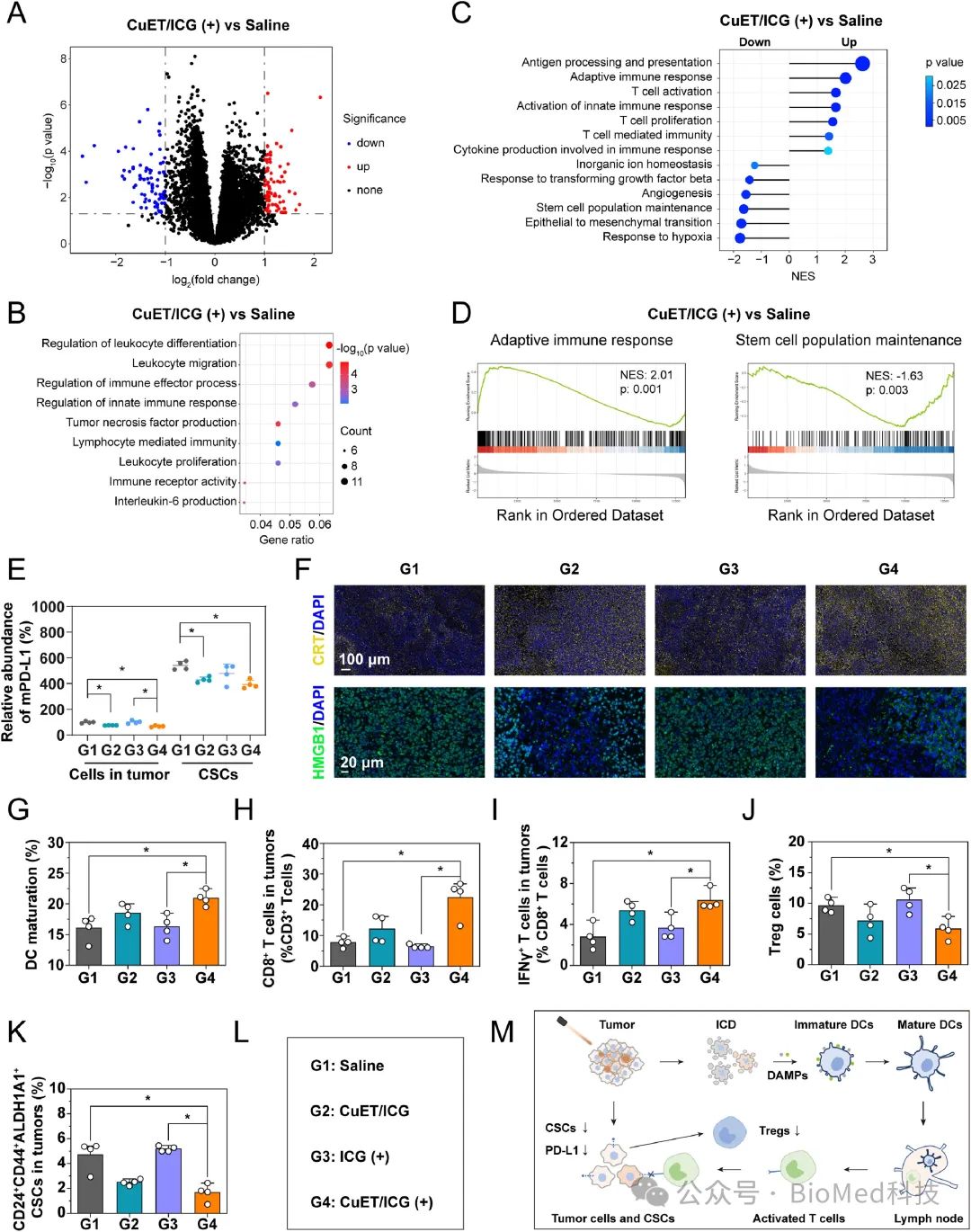
图3. CuET/ICG NPs联合光动力治疗调节肿瘤免疫抑制微环境
如图3所示,通过转录组测序、免疫荧光切片染色和流式细胞术验证了CuET/ICG NPs联合光动力治疗能够在体内逆转肿瘤免疫抑制微环境和促进对于CSCs的杀伤。
本工作延续了课题组前期基于CuET(戒酒药双硫仑在体内的一种代谢产物)的相关研究工作(J. Controlled Release 356 (2023) 288-305,Research 7 (2024) 0335,Biomaterials 313 (2025) 122763),试图通过简单的生物医学材料克服复杂肿瘤微抑制微环境。本工作对CuET/ICG的形成机理做出了初步研究;在肿瘤生物学方面,本工作探究了CuET在免疫调控中的独特生物学功能,进一步阐述了CuET调控肿瘤免疫抑制微环境和抑制肿瘤干细胞的相关机理。
【作者简介】
华中科技大学李子福教授: 博士生导师,入选国家高层次青年人才、湖北省海外高层次人才、华中科技大学学术前沿青年团队项目、Biomaterials Science 2022年Emerging Investigators,研究方向为生物力纳米肿瘤学。担任国家药品注册审评专家咨询委员会专家、“湖北省生物无机化学与药物”重点实验室及“生物医用与防护材料湖北省工程研究中心”副主任,被选为中国抗癌协会纳米肿瘤学专业委员会委员、中国抗癌协会纳米肿瘤学青年委员会常委、中国药学会药剂学青年委员会委员、中国毒理学会纳米毒理学专业委员会委员、中国免疫学会肿瘤免疫及生物治疗专业委员会委员。在Nature Communications,Angewandte Chemie International Edition, Advanced Functional Materials, Advanced Science, Biomaterials, Chemical Society Reviews, Accounts of ChemicalResearch等期刊发表 SCI论文90余篇,他引4400余次,H因子38,申请中国发明专利30件(其中已授权25件),申请PCT国际专利5项、美国专利1项,参编英文专著2部,主持国家自然科学基金项目3项、参与科技部重点研发计划项目2项,研究工作获临床试验伦理批件2项。
课题组主页:
https://www.x-mol.com/groups/li_zifu
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S0142961225000134


