上海交大/苏大Chem:可空间匹配抗原的聚适配体纳米结构,阻断冠状病毒感染和缓解炎症
时间:2024-12-21 12:00:50 热度:37.1℃ 作者:网络
治疗HCoV
严重急性呼吸系统综合征(SARS)、中东呼吸综合征(MERS)和严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)等流行病凸显了迫切需要为意外的人类冠状病毒(HCoV)爆发制定应急响应策略。由于HCoV经常引起肺部炎症,因此抑制病毒感染同时减轻炎症反应至关重要。
HCoV感染始于由S1和S2亚基组成的病毒刺突糖蛋白(S蛋白)。S1包含一个重要的受体结合结构域(RBD),该结构域能够结合细胞受体,如血管紧张素转换酶2(ACE2)或二肽基肽酶4(DPP4),并负责识别宿主细胞。S2亚基主要负责病毒与宿主细胞的后续融合及其进入宿主细胞。因此,开发针对S蛋白的药物,特别是RBD,可以有效预防病毒进入并减轻HCoV感染。在过去的20年里,S蛋白融合抑制剂的开发一直是对抗HCoV感染的关键策略。此外,HCoV的感染可能会加剧炎症免疫反应,引发诱导急性肺损伤(ALI)的细胞因子级联反应。因此,管理新出现的HCoV及其并发症的一种有效策略是在病毒感染期间同时抑制S蛋白介导的受体识别、细胞附着和融合,同时缓解异常的肺部炎症反应。
可空间匹配抗原的聚适配体纳米结构
受构象表位匹配的启发,上海交通大学杨宇研究员和苏州大学Yuqing Li等人设计了一种抗原空间匹配的聚适配体(ASM-pAPt)纳米结构,用于与严重急性呼吸系统综合征冠状病毒2型假病毒(PsV)上的多个刺突蛋白精确对齐。结果表明,与单价适配体相比,ASM-pApt的解离常数(KD)降低了1000多倍,其病毒半抑制浓度(IC50)提高了100000多倍,达到89.7 fM。此外,通过负载多酚和壳聚糖(CS),聚适配体表现出抗炎和长期药物保留特性,可作为未来新兴HCoV的抗病毒/抗炎候选物。相关工作以“Antigen spatial-matching polyaptamer nanostructure to block coronavirus infection and alleviate inflammation”为题发表在Chem。

【文章要点】
使用S蛋白阻断抗体的免疫治疗引起了人们的强烈兴趣。然而,挑战仍然存在,包括变异毒株(VOCs)的持续出现、漫长的开发周期、单独使用时的不令人满意的结果、和抗体依赖性增强(ADE),即在免疫反应过程中产生的抗体识别并结合病原体,但不能预防感染。因此,进化的HCoV谱系和亚系带来的持续风险要求开发具有较短开发周期和对S蛋白突变更有效反应的“抗体”,以取代蛋白抗体。为了解决这一问题,作者所在团队已经开发了一类功能性DNA或RNA,也称为“化学抗体”或适配体,其特征是开发周期短、易于化学合成和修饰、生产成本低、在极端环境中化学稳定性强。然而,由于病毒表面结构的复杂性,目前使用中和适配体的治疗方法并没有产生令人满意的结果。因此,在本研究中,作者探索了抗原空间匹配(ASM)多价适配体是否会成为一种提高靶结合能力和阻断效率的新方法。
除了抗病毒策略外,HCoVs感染后肺部并发症的管理是另一个关键问题,因为感染后肺泡上皮和肺毛细血管内皮细胞的损伤通常会导致急性肺部炎症和急性肺损伤。研究表明,肺部并发症的进展与自由基的过度产生有关,如活性氧(ROS),以及炎症自由基循环的形成,即大量自由基积聚引起的慢性炎症。因此,一种有前景的策略是通过清除多余的ROS来缓解炎症。然而,肺部独特的生理屏障使口服和注射治疗的有效性复杂化。相比之下,雾化肺部给药直接针对肺部。因此,它具有显著的益处,包括高局部药物浓度、减少全身不良反应、易于给药、,并提高了合规性。然而,克服气道上皮粘膜屏障等挑战仍然存在。因此,开发能够穿过肺上皮粘膜屏障并破坏炎性ROS循环的药物是治疗肺部并发症的一个重大挑战。综合以上所述,作者报告了一种基于聚适配体(ASM-pApt)的纳米药物,该药物具有ASM、抗炎特性和穿过气道上皮-粘膜屏障的能力。它在中和病毒感染方面表现出显著疗效,在缓解急性肺部炎症和急性肺损伤方面表现出同等疗效(图1)。
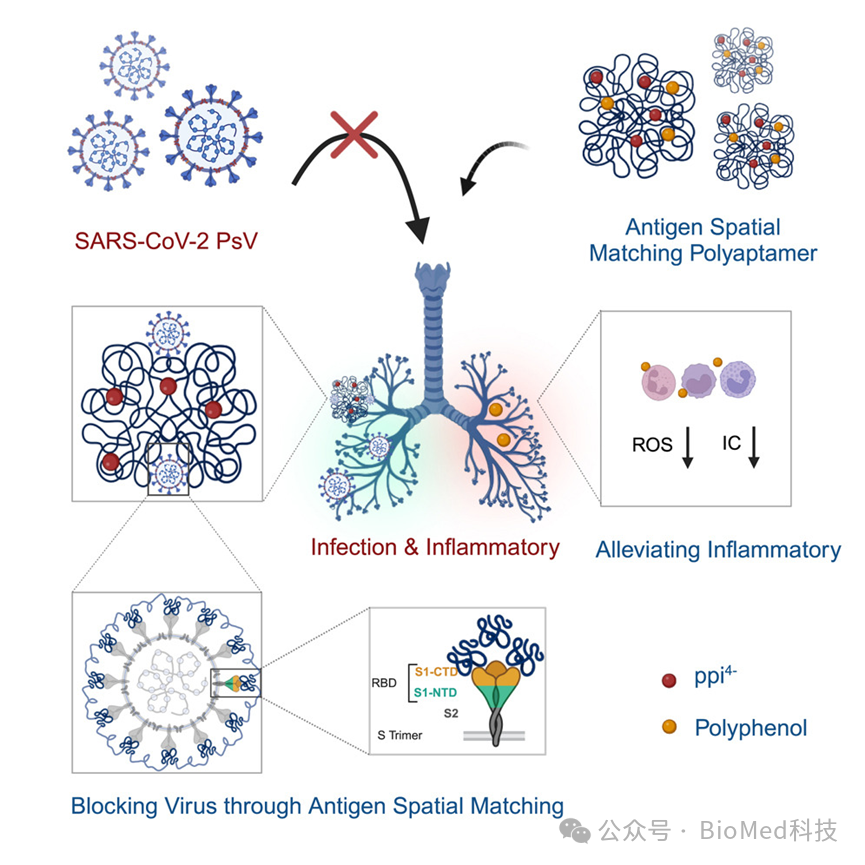
图1 通过抗原空间匹配抑制病毒
为了制造ASM-pApt,首先作为模板的包含单价适配体的互补序列的线性寡核苷酸、接头序列与DNA引物配对形成环。然后,模板的头部和尾部通过T4 DNA连接酶共价连接,然后通过phi29 DNA聚合酶促进的完善的滚环扩增反应,产生含有数十个适配体单元的长链DNA。退火后,形成了含有大量适配体的海胆状DNA纳米结构。通过精确控制适配体之间的连接距离和DNA纳米结构的尺寸,获得了与HCoVs上的多个S蛋白在空间上对齐的聚适配体纳米结构(ASM-pAPt)。在负载鞣酸(TA)后,即可形成ASM-pApt-TA纳米结构(图2)。
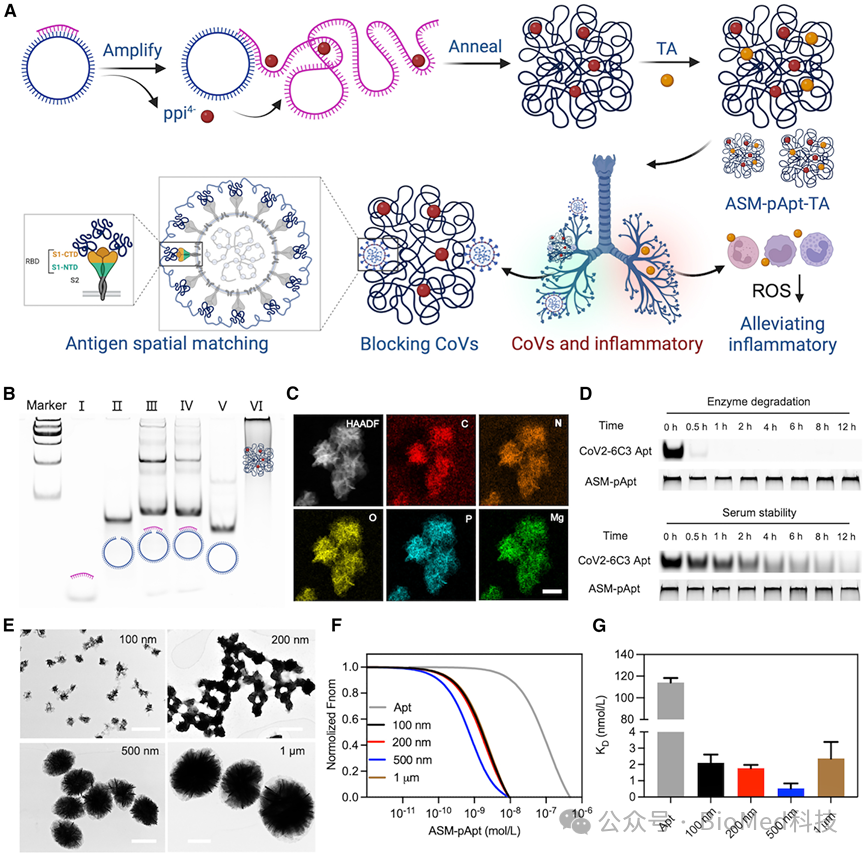
图2 ASM-pApt纳米结构的制备与表征
以严重急性呼吸系统综合征冠状病毒2型假病毒(PsV)为模型,分子动力学模拟和结合实验表明,只有连接距离为30个核苷酸(nt)的聚适配体能有效阻断S蛋白三聚体的RBD区,表明间隔为30nt的聚适配体与S蛋白三聚物最佳匹配。此外,尺寸为500 nm的ASM-pApt纳米结构与病毒上的刺突(S)蛋白分布很好地对齐。因此,这种连接距离为30 nt、尺寸为500 nm的结构对严重急性呼吸系统综合征冠状病毒2型表现出最高的结合亲和力,ASM-pApt纳米结构的解离常数(KD)降低了1000多倍,病毒半抑制浓度(IC50)提高了100000多倍,达到89.7 fM。此外,负载多酚的纳米结构提高了ROS清除能力,从而产生了抗炎作用。为了使ASM-pApt纳米结构能够穿过肺部的气道上皮-粘膜屏障,壳聚糖(CS)作为赋形剂形成CS/ASM-pApt-TA,显著提高了药物的渗透和滞留,从而有效缓解了肺组织的炎症反应(图3)。
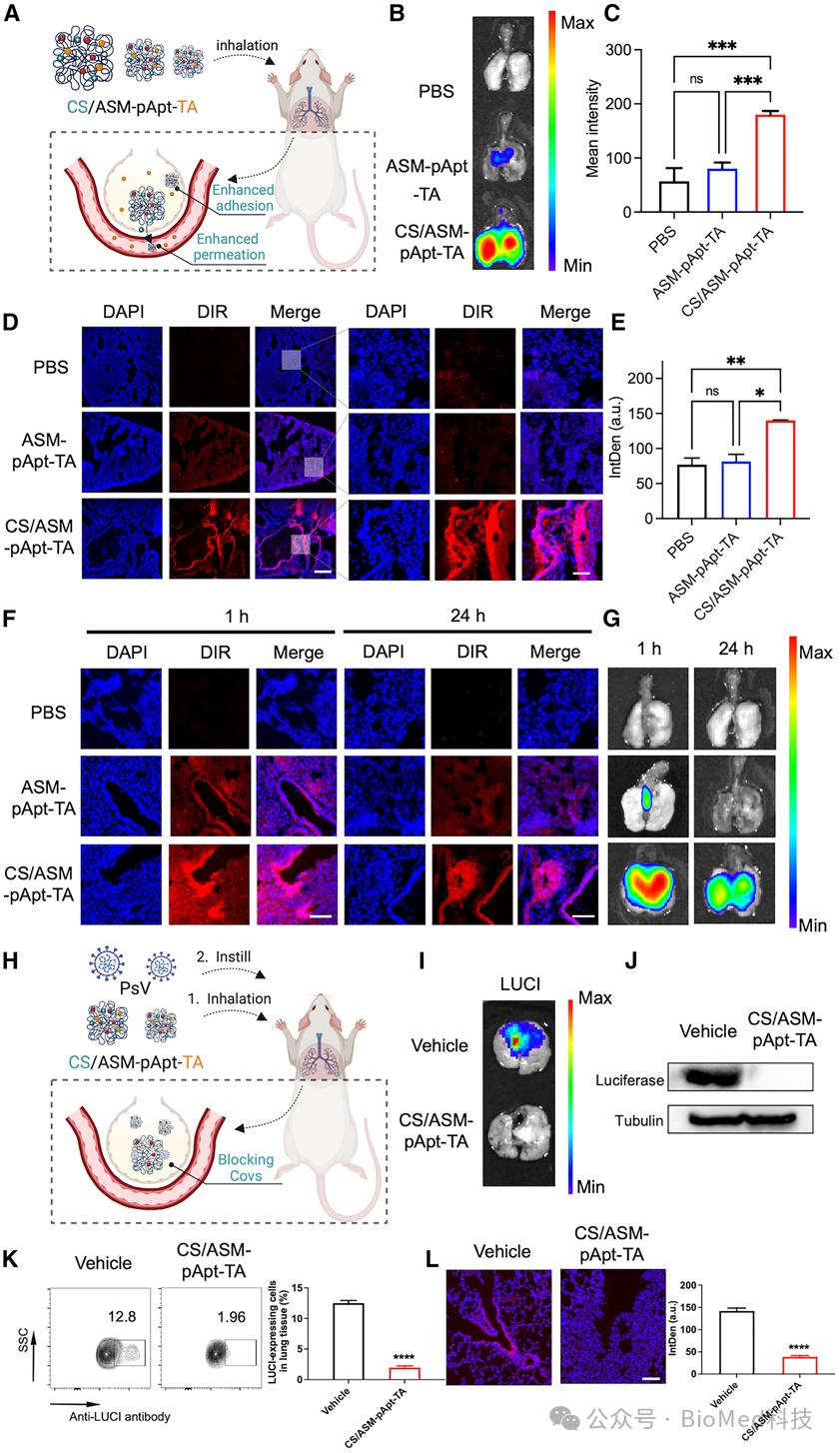
图3 CS/ASM-pApt-TA纳米结构的粘膜吸收和穿透性
结论与展望
总之,该研究开发了一种通用的冠状病毒治疗平台,可以抑制冠状病毒感染并缓解急性肺损伤。通过改变适配体序列、连接距离和纳米结构尺寸,上述聚适配体纳米平台可以快速开发为病毒阻断药物,以应对未来新出现的冠状病毒。
原文链接:
https://www.cell.com/chem/fulltext/S2451-9294(24)00547-3


