白癜风免疫发病机制的研究进展
时间:2025-03-29 12:12:12 热度:37.1℃ 作者:网络
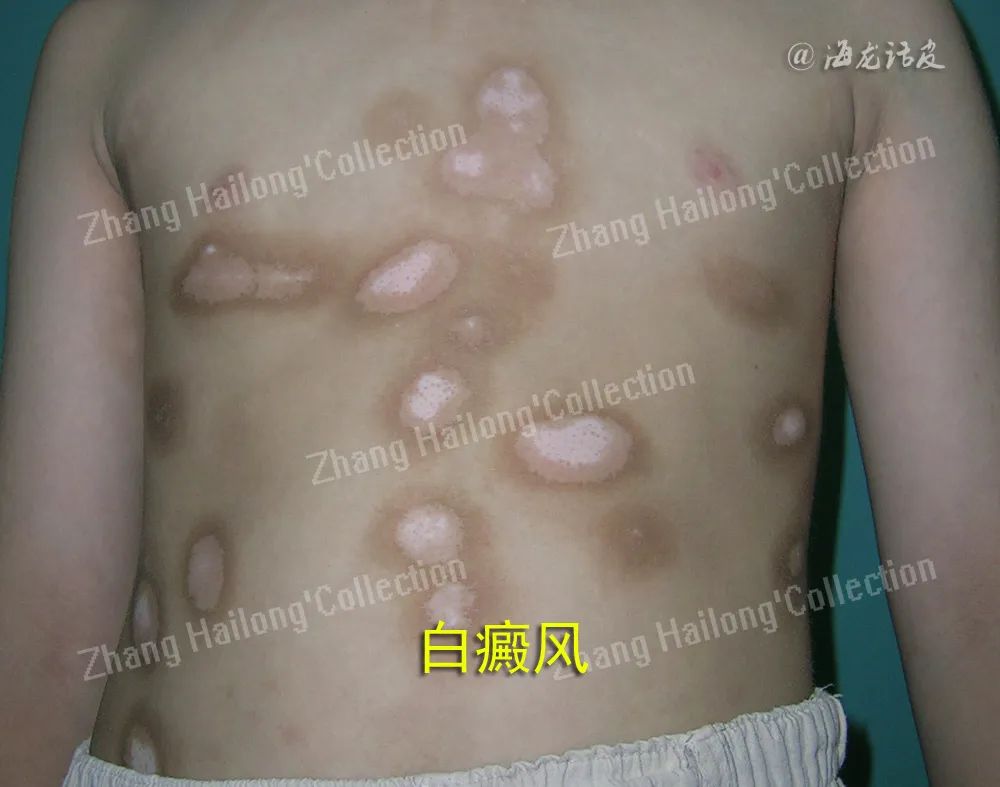
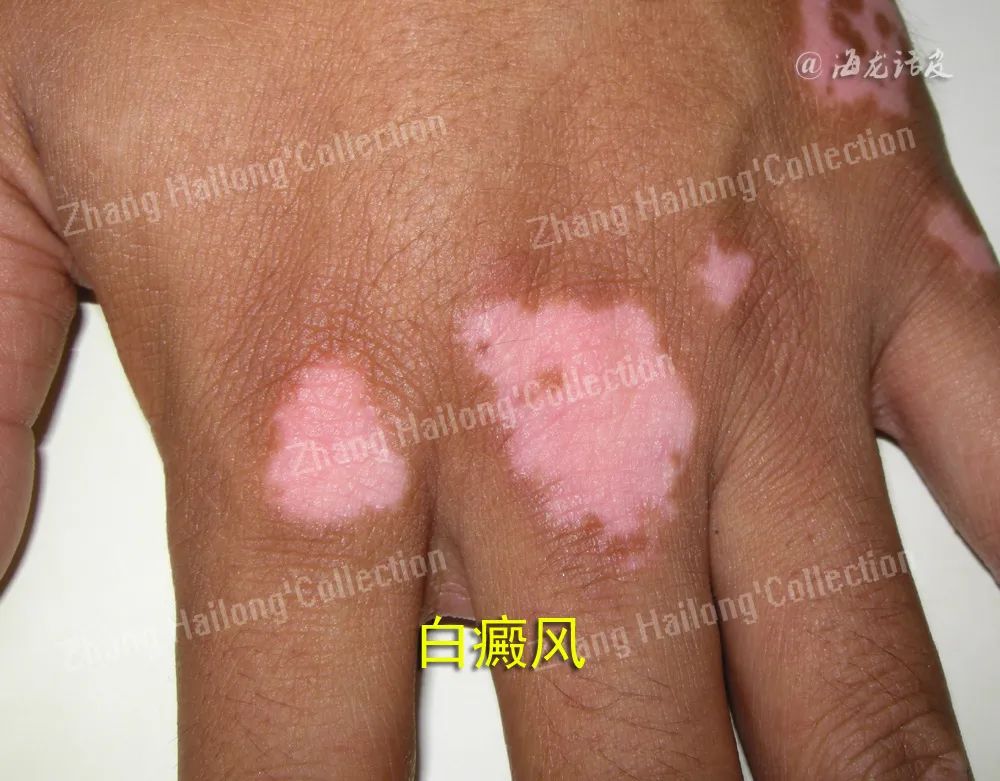
白癜风并不是一种先天性疾病,主要是后天因素造成的,也是一种毁容性疾病,皮肤白斑是由受累部位黑素细胞自身免疫性丧失引起的。世界上大约有1%的人口患有白癜风,美国食品和药物管理局(food and drug administration,FDA)也没有批准任何治疗方法。

白癜风是一种涉及遗传和环境因素的多因素疾病,在白癜风所有的病因中,对自身免疫发病机制的研究已成为一个发展迅速的领域。一些工作者通过检测循环抗体发现白癜风的发病机制与体液免疫有关,皮损周围皮肤的组织学和免疫组织化学研究表明白癜风与细胞免疫有关,免疫病理机制的最新进展为创新治疗策略开辟了道路。
遗传因素
目前尚缺乏关于白癜风确切遗传方式的报道,但家族聚集性研究则证实遗传与白癜风的致病因素之间具有某种关联,其遗传模式不符合孟德尔遗传法则。流行病学统计发现,大约20%的白癜风患者至少有一位一级亲属患有白癜风,白癜风患者的亲属患白癜风的风险是普通人群的6~18倍,家族聚集性病例很常见。量化白癜风患病发病机制中属于遗传因素的指标被称为“遗传力”,(通常表示为h2)。最新研究表明,在白癜风患病率约为0.40%的欧洲,基于多个家族研究,白癜风h2为0.75~0.84,具体取决于研究的亲属类型。
随着高通量测序技术的快速发展,为了更好地研究白癜风发病机制中遗传因素发挥的作用,从20世纪60年代中期开始,研究人员开始应用一系列不断发展的基因技术来阐明白癜风的遗传机制,并确定潜在的白癜风易感基因。JIN等通过全基因组关联研究(genome-wide association study,GWAS),已确定了约40个白癜风易感位点,包括MC1R、TYR、IFIH1、CD44、CD80、GZMB、HLA-A、XBP1、CAT和MTHFR。在已确定的候选基因座中,一半以上与免疫调节、T细胞受体和免疫细胞的凋亡有关, 表明免疫功能异常在白癜风发病机制中的关键作用。
与免疫调节相关的基因有TYR编码酪氨酸酶,它不仅是一种催化黑素生成的酶,也是黑素细胞表面人类白细胞抗原-A呈现的自身抗原,朗格汉斯细胞将酪氨酸酶表位呈递给未成熟T细胞以激活自身免疫反应,最终诱导黑素细胞凋亡;与T细胞受体相关的基因有转录因子叉头盒P3(Foxp3),其基因多态性影响Treg细胞的调节功能,失去了Treg调节,CD8+T细胞分泌多种细胞因子杀伤黑素细胞;GZMB是典型的与免疫细胞凋亡相关的基因,GZMB编码的颗粒酶B是一种丝氨酸蛋白酶,可激活细胞毒性T细胞,其中CD8+T细胞(细胞毒性T细胞的一种)表面表达的CD107a是其激活诱导脱颗粒的标志,因此颗粒酶B可作为评价CD8+T细胞毒活性的指标。随着人类基因组计划的最终实现和后基因组及蛋白质组时代的到来,人类对白癜风的病因一定会有更加深刻的了解。
细胞免疫因素
黑素细胞特应性T细胞
CD8+T淋巴细胞(cy‐totoxic lymphocyte,CTL)是T淋巴细胞的一个亚群,又称细胞毒性T细胞,是由幼稚T细胞在胸腺中分化而来,能分泌各种细胞因子参与免疫作用,而且对一些侵入人体的病毒、异常增殖的肿瘤等抗原物质有杀伤作用。浸润到周围边缘的细胞毒性T细胞与疾病的发病机制有关,黑素细胞抗原特异性T细胞存在于病灶周围白癜风皮肤中,并被证明能够在体外杀死黑素细胞。黑素细胞抗原特异性刺激后,病灶周围的CD8+T细胞被激活。同时,白癜风患者的CD8+T细胞能够杀伤无皮损部位的黑素细胞。RIDING等通过将黑素细胞特异性CD8+T细胞过继转移到受体小鼠中,随后使用病毒载体激活这些T细胞,即可诱导白癜风。
白癜风患者的CD8+T淋巴细胞表达颗粒酶B、TNF-α、穿孔素和IFN-γ的频率高于健康对照组,IFN-γ和TNF-α表达增加将诱导趋化因子CXC配体9(CXCL9)和CXCL10分泌,导致携带趋化因子受体3(CXCR3)的T细胞在皮肤中募集,从而增强炎症反应。还有研究认为CD8+T细胞诱发白癜风的机制依赖于Fas分子,靶细胞上出现Fas,与CD8+T细胞的FasL结合介导靶细胞凋亡。
白癜风特应性T细胞还有很多种,比如白癜风患者在自身抗原刺激下,在缺乏适当的Tregs数量或功能的情况下,这些细胞可能会被激活,并可能导致异常免疫反应的发生,若补充周围皮肤Tregs可以防止色素脱失,但产生足够数量的用于临床的多克隆Treg可能是一个难度不小的挑战。Tregs属于CD4+T细胞的一个亚群,通过抑制免疫细胞(包括自身反应性、细胞毒性T细胞)来维持免疫稳态,从而负责外周免疫耐受,一般情况下Treg细胞主要通过直接或间接方式抑制效应T细胞的增殖,直接方式为Treg细胞通过与CTLA-4等靶细胞的结合受体结合,降低靶细胞对IL-2的反应性而抑制效应T细胞的增殖;间接方式为分泌抑制性细胞因子如IL-10、IL-4来介导机体免疫应答。
白癜风患者皮损、非皮损和皮损周围皮肤中发现局部Tregs缺乏,表明白癜风患者维持外周免疫稳态的能力降低。Foxp3在抑制自身反应性T细胞发育和功能中起关键作用,GWAS将其确定为导致白癜风风险的易感位点。有研究表明,活化T细胞(NFAT)的核因子(调节Foxp3表达)水平降低会减弱Foxp3表达,同时下调了Treg中的免疫抑制基因(IL-10、CTLA-4、TGF-β),这可能会损害白癜风患者的Treg功能。Treg的免疫抑制性表现在经TCR介导的信号刺激活化后能够抑制CD8+T细胞活化和增殖。白癜风小鼠的动物实验表明,采用一定手段激活小鼠Treg可以增加皮肤中Treg含量,从而改善白癜风的皮肤病变。
辅助性T细胞17(helper T cell 17,Th17)是一种独特的效应CD4+T辅助细胞谱系,是Th0细胞在IL-6和IL-23的刺激下分化而成的辅助性T细胞,可介导炎症反应,也参与白癜风的发病机制,并在皮 损皮肤和血清中增加IL-17的表达,其中IL-17A(Th17细胞的标志性细胞因子)最为关键,IL-17A可以刺激角质形成细胞和成纤维细胞分泌TNF-α,进而影响免疫耐受,导致黑素细胞损伤,故通过抑制Th17的分化或使用IL-17抗体可以缓解自身免疫性疾病。现已发现Th17可浸润白癜风皮肤。
Th17细胞弥漫性渗透到真皮上部,因此其可能通过分泌细胞因子而不是直接相互作用于黑素细胞,大量研究表明,白癜风患者血清Th17、血清IL-17、病变组织IL-17mRNA、病灶周围皮肤IL-17A和IL-17A受体水平相对较高,NB-UVB光照治疗可降低病变和病变周围IL-17的表达,同时降低白癜风面积评分指数(vitiligo area score index,VASI),提示Th17参与白癜风。GHOLIJANI等采用复合细胞因子分析法测定44例白癜风患者的Th2(IL-4、IL-5、IL-10、IL-13)和Th17(IL-17、IL-23)细胞因子,并与44例健康人进行比较,所有患者的先天免疫(P<0.04)、Th1(P<0.01)、Th2(P<0.05)和Th17(P<0.001)细胞因子水平高于对照组。以上数据表明在血液循环CD4+T细胞亚群中,Th1和Th17在白癜风进展期的细胞免疫中起主导作用。为研发以Th17细胞为靶点的白癜风治疗药物提供了新的思路。
树突状细胞(dendritic cell,DC)
DC是已知的功能最强的抗原递呈细胞(antigen presenting cells,APCs),未成熟的DC易迁徙,成熟的DC能激活T淋巴细胞,共同发挥免疫调节作用。白癜风的病灶附近区域的炎症细胞,包括T细胞毒性细胞、辅助细胞和巨噬细胞数量异常增多。DC通过向T细胞递呈抗原或产生细胞因子来调节免疫活动,促炎和抗炎DC负责各自的细胞因子释放。在白癜风发病机制中,由于未知的原因促使DC将色素细胞识别为外来颗粒,并触发T细胞终止,从而导致疾病的发生,DC产生的细胞因子也被认为是自身免疫性疾病中细胞因子的重要来源。
SRIVASTAVA等评估了稳定期和活动期白癜风患者的DC标志物(CD11b和CD11c)以及促炎和抗炎细胞因子(IL-17A、IL-10和IL-12p70),结果显示,与对照组和稳定白癜风组相比,活动期白癜风患者的外周血单个核细胞(pe‐ripheral blood mononuclear cell,PBMC)和皮肤组织中CD11b+CD11c(促炎+DC)的表达显著增强。与之相反,与另外两组相比,活动性白癜风组的CD11b+(抗炎DC)水平显著降低。总之,活动期白癜风患者促炎和抗炎DC的调节可能会影响细胞因子的产生,从而导致皮肤进一步脱色。DC数量极低,在人和动物外周血中低于白细胞总量的1%,因此难以在体外获得大量纯化DC,一定程度上制约了DC在白癜风发病机制中的研究,DC具有诸多表面受体而成为研究热点,表明受体及其靶向药物具有较好的应用前景。
细胞因子
皮肤淋巴细胞相关抗原(cutaneous lympho‐cyte-associated antigen,CLA)
CLA是一种表面标志物,15%的人体循环T细胞上存在CLA,表达于循环效应器和中枢记忆T细胞以及大多数(>90%)皮肤浸润性T细胞的表面,而T细胞的活性与患者皮肤淋巴细胞的抗原水平有关,是引发白癜风的主要原因,而CLA可选择性作用于患者皮肤并与皮肤淋巴细胞相关抗原T细胞相互作用,使皮肤淋巴细胞相关抗原T细胞吸附并黏附于血管内皮细胞,从而导致细胞血管皮肤归巢,具体过程为在皮肤中,CLA通过与E选择素的弱相互作用介导T细胞从血管向组织外渗的初始阶段,E选择素在促炎细胞因子激活后在内皮细胞上表达,选择素将白细胞束缚在趋化因子和其他局部刺激下。
趋化因子激活整合素,包括T细胞表面的淋巴细胞功能相关抗原1(leuko‐ cyte function-associated antigen-1,LFA-1)亚单位,通过锚定免疫球蛋白超家族分子,如皮肤内皮细胞上的细胞间黏附分子1(intercellular cell adhesion mole‐cule-1,ICAM-1),使其牢固地黏附。因此,一些学者建议,皮肤淋巴细胞相关抗原T细胞数量异常患者可以服用维A酸及维生素D进行治疗。其治疗机制为维生素D增加黑素细胞的小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)蛋白表达,MITF参与酪氨酸基因表达增加和黑色素调控。
IFN-γ
IFN是一类糖蛋白,当机体感染病毒时由免疫细胞分泌,具有抗病毒、抗菌、抗肿瘤等功能。IFN-γ是一种多功能细胞因子,可介导抗病毒和抗菌免疫反应,激活固有免疫系统,增强抗原提呈,促进巨噬细胞活化,调控细胞增殖和凋亡。
据报道,关于CD8+T细胞引起白癜风的机制, CD8+T细胞产生的细胞因子IFN-γ是决定疾病发展的核心物质。自身反应性细胞毒性CD8+T细胞通过产生IFN-γ与局部黑素细胞结合并影响疾病发展,然后从周围角质形成细胞分泌IFN-γ诱导的趋化因子,通过正反馈环进一步募集T细胞到皮肤。JIMBO等利用CTL依赖性白癜风小鼠模型进行实验,约65%受检小鼠被诱导出现白癜风样皮毛颜色改变,在诱导的白癜风皮肤组织中,与对照小鼠的正常皮肤组织相比,IFN-γ表达显著增加(P<0.05),这一结果与先前报道的白癜风患者皮损中IFN-γ表达升高一致。因此一些抑制IFN-γ的药物也被用于白癜风治疗,如2%托法替尼治疗难治性白癜风的研究结果表明局部使用托法替尼是安全有效的。
IL
IL-17是目前发现的30多种IL之一,由Th17细胞分泌。IL-17由6种细胞因子组成,包括IL-17A~IL-17F。IL-17是T细胞诱导的炎症反应的早期启动子,参与炎症反应,可通过促进促炎细胞因子的释放而放大炎症反应。IL-17与受体IL-17R结合后,可通过MAP激酶途径和NF-κB途径发挥其生物学作用。有研究表明,IL-17抑制正常人表皮黑素细胞和B16F10细胞的黑素生成。IL-17增加线粒体功能障碍和ROS积累,这与自噬诱导有关。总之,IL-17诱导黑素细胞的细胞应激微环境,促进白癜风自噬细胞凋亡。白癜风患者血清IL-17水平(t=2.08,P<0.05)显著升高已有报道,因此,调节IL-17水平,如紫外线光疗法是一种治疗白癜风的方法。
IL-15是一种免疫调节细胞因子,是细胞因子IL-2家族的成员,它由多种细胞表达,包括神经细胞、上皮细胞、单核巨噬细胞、表皮细胞和DC。IL-15对NK细胞、自然杀伤T细胞(natural killer T,NK-T)细胞、CD8+T细胞和肠上皮淋巴细胞(intraepithelial lymphocyte,IEL)的生长和功能的发挥非常重要。此外,它还能促进记忆T细胞的存活、成熟和细胞毒性。总之,IL-15对先天性免疫细胞如APC、NK细胞和适应性免疫细胞如CD8+T细胞都很重要。ATWA等研究了30例非节段性白癜风患者和30例健康对照,白癜风程度评分(vitiligo extent score,VES)和白癜风疾病活动性评分(vitiligo disease activity score,VIDA)分别用于评估白癜风的严重程度和活动性,结果表明白癜风患者血清IL-15水平显著高于对照组(P=0.001),VES评分与血清IL-15水平呈显著正相关(P=0.001),证明白癜风患者血清IL-15水平升高。
因此,IL-15可能对白癜风自身免疫发病机制产生重大影响,进一步确定其分子作用可能会发现白癜风的新治疗策略。CHEN等研究发现白癜风表皮中IL-15表达显著增加,并且与表皮H2O2含量高度相关,人角质形成细胞不仅组成性表达IL-15,而且表达IL-15受体,然后发现氧化应激通过激活角质形成细胞中的NF-κB信号促进IL-15表达, 进一步研究了反式表达的IL-15增强CD8+TEMs激活的机制,发现阻断IL-15-JAK-STAT信号可能是一种有效治疗方法。
TNF-α
TNF-α由巨噬细胞、B淋巴细胞和T淋巴细胞、肥大细胞和DC合成的多效促炎细胞因子组成。TNF-α介导多种生物学功能,如细胞生长、凋亡、炎症和自身免疫,还通过抑制黑素生成中酪氨酸酶和酪氨酸酶相关蛋白的酶活性,介导抑制黑素细胞干细胞分化以及抑制黑素合成。因此,TNF-α通过促进黑素细胞损伤和抑制黑素生成在色素沉着中发挥重要作用,此外,白癜风病变中TNF-α水平升高表明其在白癜风发病机制中具有潜在作用。
EL-RAHEEM等研究了TNF-α基因启动子区的几种单核苷酸多态性(single nucleotide polymor‐ phism,SNP)可引起基因调控位点的变异,并可作为白癜风等自身免疫性疾病的致病因素,结果表明,突变型TNF-α(308)基因型是埃及患者白癜风易感性的致病因素。GHOLIJANI等总结了健康对照组和白癜风患者的所有细胞因子水平,患者的IL-1α、IL-1β、IL-6、IL-8、IL-12、IL-15和TNF-α水平显著升高,其中TNF-α除了在诱导适应性免疫中可能发挥的作用外,在细胞增殖、趋化、凋亡和一些皮肤脱色中也具有重要作用。
TNF-α通过抑制黑素生成,降低了细胞黑素含量。TNF-α在白癜风患者皮损中的表达水平升高,FasL和TNF相关凋亡诱导配体(TNF-associated apoptosis-inducing ligand,TRAIL)协同诱导人黑素细胞凋亡。基于这些研究,有学者尝试用TNF-α抑制剂或抗肿瘤坏死因子治疗白癜风,然而结果并不一致。JAOUAD等研究发现,抗肿瘤坏死因子用于治疗白癜风,患者在局部治疗下未出现任何新的无色区扩展,且色素重新沉着。但BAE等研究发现接受抗肿瘤坏死因子治疗的患者与接受常规治疗的患者相比,患白癜风的风险大约增加了2倍。因此目前研究结果不支持TNF-α抑制或抗体剂用于白癜风的治疗。
趋化因子
趋化因子是一种低分子量蛋白质,其受体是位于白细胞表面的G蛋白偶联受体(Gprotein-coupled receptor,GPCR),其功能是通过与GPCR结合实现。趋化因子系统由48个趋化因子和23个受体组成。趋化因子配体与其受体结合可以募集和激活细胞内G蛋白,从而启动多种信号通路。趋化因子可以通过肌动蛋白重组启动细胞定向运动。趋化因子与细胞外基质糖胺聚糖(glycos‐aminoglycan,GAG)的结合进一步建立了趋化因子梯度,允许白细胞定向运动,其他功能包括整合素激活、白细胞脱颗粒、血管生成或血管抑制。
C-C基序趋化因子配体(C-C motif chemokine li‐gand 22,CCL22)是巨噬细胞源性趋化因子,通常由巨噬细胞、DC分泌,是已知的CCR4配体之一,该受体也存在于Treg细胞表面。EBY等为了验证CCL22的表达增强可以促进Treg皮肤归巢以抑制色素脱失,利用两种具有不同黑素细胞丢失动力学的自发脱色模型表达酪氨酸酶反应性和gp100反应性TCR转基因,小鼠每隔6d接受5次基因枪治疗,此后每周扫描脱色,并监测相关T细胞的激活和增殖以及Treg对皮肤的浸润,治疗2周后色素脱失显著减少,伴随着皮肤中Treg的丰度显著增加,这些发现表明局部CCL22可用于治疗白癜风。
CXCL10与Th1模式相关,并被认为是在不同的自身免疫和炎症反应中促进T细胞迁移的相关性最高的趋化因子之一。EL-DOMYATI等评估CX‐CL10作为白癜风进展和治疗预测因子的效用,采用定量ELISA测定白癜风患者(n=30)皮损、皮损周围和未受影响皮肤以及血清(n=51)中CXCL10水平,通过组织化学(n=32)和免疫荧光(n=10)染色评估CXCL10表达、白细胞募集和炎症浸润,采用严格的横截面和纵向生物统计分析将CXCL10水平与疾病变量、治疗反应和结果相关联,采用补骨脂素加UVA(PUVA)光疗、窄谱UVB(NB-UVB)光疗和全身类固醇治疗后患者CXCL10血清水平变化与皮肤复色相关。
循环CCL20与Th1和Th17一起被报道为预测活动性白癜风的一类潜在生物标志物,同时CCL20是可诱导的,并在细胞因子IL-17A、IL-23和TNF-α的作用下上调,在人类角质形成细胞中,IL-17A通过脾酪氨酸激酶依赖的NF-κB机制诱导CCL20基因表达和蛋白质分泌,CCL20能吸引表达CCR6的辅助性T细胞,如Th17细胞,这些细胞在包括白癜风在内的自身免疫性皮肤病的发展中发挥作用。也有研究表明白癜风患者血清CCL20水平显著升高,活动期血清CCL20水平高于稳定期,经有效治疗后,血清中CCL20水平显著降低。这些报道都有力地证明了CCL20参与白癜风的发病机制。
体液免疫
事实上,通过激活病原体识别受体(pathogen recognition receptor,PRR)激活先天免疫系统是宿主防御病原体的重要机制,但在某些情况下可能受损,并可能诱发遗传易感性患者的自身免疫,所以在白癜风患者的外周血中常能检测到自身抗体。
目前与白癜风相关的黑素细胞胞浆抗原已明确,包括酪氨酸酶相关蛋白-1(tyrosinase-related pro‐ tein-1,TRP-1)和酪氨酸酶相关蛋-2(tyrosinase-re‐lated protein-2,TRP-2)、酪氨酸酶等。
自身抗体
白癜风涉及的抗体主要为IgG,包括IgG1、IgG2及IgG3,值得注意的是,IgG的荧光染色表明,从患者血清样本中获得的IgG主要与人原代黑素细胞(human primary melanocyte,HMC)和人角质形成细胞(human keratinocytes,HKC)结合,并且通常定位于细胞质和细胞膜,仅偶尔出现在细胞核区域,推测这些抗体在增加DC的抗原摄取和呈递中发挥作用。除IgG外,IgE在白癜风的发病机制中也发挥一定作用,IgE抑制Ⅰ型干扰素的产生,Ⅰ型干扰素与慢性炎症和白癜风有关,所以白癜风患者血清总IgE水平变化反映了免疫状态异常。
白癜风患者出现的免疫球蛋白可能是免疫系统对黑素细胞破坏释放的酪氨酸酶等黑素细胞特有抗原成分的反应。不同时期的白癜风患者血清免疫球蛋白也存在一定的差异。目前多数学者认为,自身抗体与黑素细胞膜抗原结合后,通过补体依赖性细胞毒性和抗体依赖性细胞毒性作用两条途径实现对黑素细胞的破坏。LI等发现全身性白癜风(generalized vitiligo,GV)患者血清样本中的自身抗体浓度明显高于对照组,尤其是体表受白癜风影响>10%的患者,该结果支持了黑素细胞特异性抗体和自身抗体在GV发展中起重要作用的假说。
自身抗原
TRP-1
近年来,随着分子生物学技术的发展,酪氨酸酶、TRP-1和TRP-2在小鼠和人类中的基因结构已被相继阐明,其长度在20~60kb。TRP-1是第一个成功克隆的色素基因,位于小鼠brown位点。TYRP1编码区的序列全长1.6kb,其翻译蛋白有537个氨基酸,包括1个信号肽。成熟的糖基化蛋白分子量约为75kD。
TRP-1是重要的黑色素细胞分红抗原,是黑素细胞含量最丰富的糖蛋白,该蛋白与酪氨酸酶有一定同源性。有研究表明TRP-1是参与黑色素生物合成中的酶之一,同时抑制M1TF,M1TF是黑素细胞最重要的调节因子,MAPK通过激活cAMP反应来激活M1TF的表达元素结合蛋白。ÜSTÜN等通过研究γ1链角质形成细胞特异性缺失(Lamc1 EKO)小鼠,发现分化特异性黑素细胞酶TRP-1水平在Lamc1EKO小鼠中降低,黑素细胞未能迁移到毛囊中分化,并在滤泡间上皮中积累,结果表明色素沉着缺陷是由受损的黑素细胞迁移引起的。
TRP-2
许多自身抗原,包括TRP-2,已经在白癜风患者的黑素细胞中被鉴定出来,抗TRP-2自身抗体与TRP-2或酪氨酸酶均可发生反应。有报道称TRP-2是跨越黑色素体膜的跨膜蛋白,有助于调节酪氨酸活性,葛缕子干籽药片可增加B16细胞中TRP-1和TRP-2的表达,黑色素相关信号通路通过MITF参与黑色素生成,经CTW治疗的白癜风小鼠,动物的肤色、含有黑色素的毛囊以及皮肤中TRP-2的表达均受到显著影响。
酪氨酸羟化酶(tyrosine hydroxylase,TH)
TH负责催化L-酪氨酸转变为二羟基苯丙氨酸。KANG等用250µmol/LH2O2处理B16F1细胞后,降低了TH的表达,从而减少黑色素的生成。同时发现α-黑素细胞刺激素、3-异丁基1-甲基黄嘌呤和甲磺酸伊马替尼可增加TH的产生,调控 TH的表达有助于促进黑色素的合成。
糖蛋白-100(glycoprotein 100,gp100)
特定的细胞免疫反应主要针对黑色素合成gp100,gp100可起到关键的杀菌作用用于黑色素细胞和黑色素瘤细胞。YI等采用酶联免疫斑点法比较白癜风患者和健康对照组的T细胞与5种自身抗原肽的反应性,分析CD8+T细胞与2种阳性肽的反应性与疾病活动和皮损面积的关系,研究结果表明2个gp100修饰肽被鉴定为自身抗原,并被发现与疾病特征密切相关,这可能在白癜风患者中起关键作用。
结语
针对白癜风的关键免疫发病机制进行特异性干预和阻断具有很大的治疗前景,寻找黑素细胞消失或破坏的确切病因和发病机制成为关键,寻找其适合的生物标志物以及促进黑素细胞生长的新药物可能成为白癜风治疗的新方向。
参考文献:
1.李锴骁,胡雯,康晓静.白癜风免疫发病机制的研究进展[J].中国免疫学杂志,2025,41:503-509.
2.ALGARNI A S,RAM-WOLFF C,BAGOT M,et al.Mogamuli‐zumab-induced vitiligo in patients with Sézary syndrome:Three cases[J].Eur J Dermatol,2021,31(2):213-216.
3.JADEJA SD,MAYATRA JM,VAISHNAV J,et al. A concise review on the role of endoplasmic reticulum stress in the develop‐ment of autoimmunity in vitiligo pathogenesis[J]. Front Immunol,2021,11.
4.参考文献(略).


