多普勒联合评估心源性休克的内脏灌注和充血:一种生理学方法
时间:2025-03-29 12:12:04 热度:37.1℃ 作者:网络


近十年来,心源性休克(CS)的流行病学发生了显著变化,急性失代偿性心力衰竭(ADHF)而非急性心肌梗死(AMI)成为更常见的病因(分别为 40-50% 和 30%)。虽然器官灌注不足是这两种病因的共同病理生理学特征,但主要诱因和临床轨迹却大不相同。ADHF 患者在接受指导性药物治疗的过程中,会出现长期的神经激素适应性改变,导致心肌重塑、器官功能储备减少和受压血容量(SBV)增加,这在很大程度上造成了中心静脉压和器官静脉压的升高。急性心肌梗死和 ADHF 相关 CS 的另一个显著区别在于疾病的时间进程。前者是一种纯粹的低灌注病理生理学,与急性冠状动脉闭塞导致心脏性能下降有关。ADHF-CS 是一种多系统疾病,由于器官充血逐渐恶化,导致心室收缩力降低,从而导致平均动脉压 (MAP) 和心输出量 (CO) 严重下降。这两种情况如果不能及时发现,都可能迅速从 SCAI B(心血管血管造影和介入学会)发展为严重多器官功能衰竭(SCAI C-D),并危及生命。
因此,在临床实践中纳入可在床旁进行评估的新多普勒变量来提高风险预测的准确性,对于及时发现明显的充血并防止病情进一步恶化至关重要。
“心-内脏”轴--病理生理学
新的证据表明,心力衰竭(HF)患者的心脏和脾脏之间存在紧密的联系,这种联系被称为 “心-内脏”轴。当 CO 值过低时,反射性交感神经激活会导致外周动脉和静脉血管收缩,将血液从脾脏循环重新分配到心脏、呼吸肌和大脑的灌注中。这种机制可通过主动静脉收缩和被动弹性回缩将脾脏血液主动排入体循环,即使脾脏动脉血流明显减少也是如此。在交感神经系统启动时,这两种机制对血容量转移的贡献相同,最终导致限制性静脉顺应性模式。在健康成年人中,这种机制是前负荷募集以增加 CO 的一种手段,而在心力衰竭(HF)患者中,由于总血容量升高和静息心脏充盈压升高,心脏功能储备耗竭,这种器官串扰可能是导致急性心脏失代偿的触发因素。
CO被认为是评估和监测心血管衰竭严重程度的关键参数。然而,绝对值应与患者的基线特征和合并症相结合。如果患者既往没有心血管病史,又患有急性心肌梗死或急性新发心力衰竭,那么最低的临界值(心脏指数小于 2.2 升/分钟/平方米)无疑会导致 CS。无论射血分数高低,处于失代偿前期的慢性心房颤动患者在静息状态下可能表现为低置信区间(CI),但没有典型的低灌注临床表现(如毛细血管再充盈时间、血乳酸、尿量),全身动脉压保持稳定,这是反射性血管收缩的反应。然而,在这种休克前阶段,超声多普勒已经可以检测到器官充血的迹象,这表明从累积性充血到 SCAI B 超前是一个连续的过程(图 1)。这是因为 ADHF 的病理生理学特点是对多个器官系统产生上下游影响,尤其是对动、静脉脾循环的影响。
“心-内脏”轴--多普勒评估
可通过评估动脉肾脏多普勒阻力指数(RDRI)来检测 CO 功能储备降低的临床后果,该指数可早期识别血管对组织缺氧的收缩反应,与混合静脉血氧饱和度(SvO2)相关,与是否存在其他宏观血流动力学异常和正常动脉氧合参数无关。因此,它代表了正在发生的脾组织灌注不匹配的标志。然而,动脉多普勒 RI 作为一个独立的参数,尽管总结了全身血流动力学的所有主要决定因素,包括充血和灌注失配,但并不能区分不同的脾脏灌注改变模式。事实上,多普勒 RI 是根据 Pourcelot 公式得出的,通常是收缩期峰值和舒张末期血流速度之差除以收缩期峰值速度,公式为 RI = 1- (Vdiast/Vsyst)。鉴于血流速度等于血流量除以管腔面积(LA),而血流量等于血压差,因此该公式可表示为 RI = 1 - [(Pdiast-P0) / Psyst - P0) x (LAsyst / LAdiast)],其中 P0 代表间隙压和静脉压的组合(即所谓的 "脾实质毛细血管楔压")。
考虑到方程的扩展形式,主要的决定因素如下:
- 舒张压与收缩压之比:是脉压的反比例函数,突出了脉压的关键作用。
- 间质压力和静脉压力的组合:反映实质毛细血管楔压,表明间质条件对血管动态的影响。
- 收缩期和舒张期的血管面积比:代表血管顺应性的功能,代表不同心动阶段血管壁的弹性/刚度。
- 下游静脉顺应性:与上游动脉顺应性一起影响搏动血流,使静脉充血成为阻力指数(RI)的关键决定因素。
因此,仅评估 RDRI 无法区分是动脉流入量减少导致的灌注不足,还是器官充血导致的静脉顺应性降低。通过评估肾静脉血流和门静脉搏动指数(PVPI)对脾区静脉搏动性进行多普勒背景评估,可能有助于确定是否存在最终的静脉顺应性降低。多普勒评估 PVPI 动态血流改变的特点是搏动或间断模式,这取决于体液超负荷或有无体液超负荷导致的全身静脉顺应性降低。然而,单独评估脾静脉搏动性也有一定的局限性。一方面,没有静脉搏动并不能排除早期低灌注。另一方面,脾脏区域的静脉搏动虽然总是病理性的(儿童或瘦弱和年轻的受试者除外),但并不能区分导致搏动的根本原因(例如,伴有或不伴有儿茶酚胺激增导致静脉顺应性耗竭的体液超负荷与伴有儿茶酚胺激增导致静脉顺应性耗竭的右心室功能衰竭)。后一点可通过现有的 “心-脾”轴来解决。脾脏在生理上是一个容积库,其功能性超声评估基于对脾脏大小、容积和脾脏多普勒阻力指数(SDRI)的评估。
脾脏受肾上腺素能受体的影响,在低血容量、低氧或低充血的病理生理学过程中(如左心室CS-AMI),儿茶酚胺激增导致脾脏挤压(体积小-容量低-SDRI增加),调动血液压力容积,以优化前负荷并增加每搏容积。
在容量超负荷的情况下,脾脏会增加其大小和容量,使 SDRI 保持在正常范围内或超过正常范围。当发生明显充血导致 ADHF-CS 早期(SCAI B)时,脾脏不会缩小,但交感神经激活会导致 SDRI 增加。因此,SDRI 可以量化脾脏充血的严重程度,是预测 ADHF 患者不良事件的可行方法。
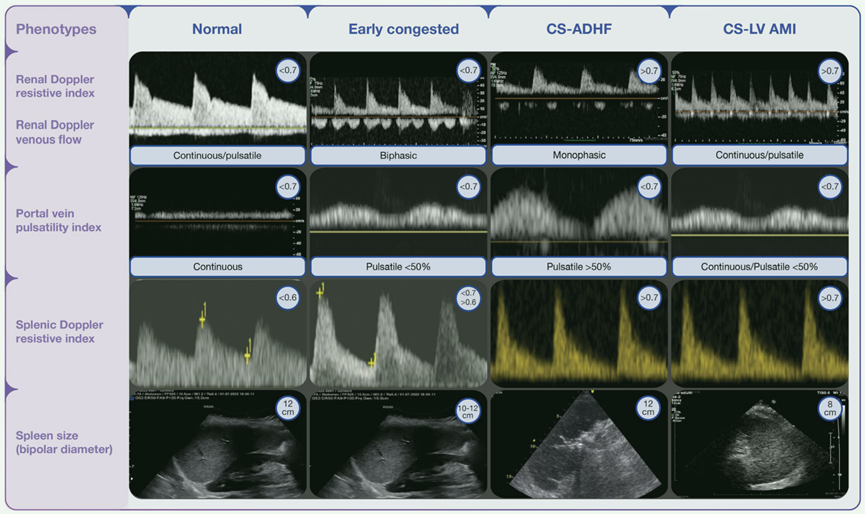
图 1 根据文中讨论的病理生理学和表型 CS 的脾脏多普勒和脾脏尺寸模式。CS-ADHF 心源性休克急性失代偿性心力衰竭,CS-LV AMI 心源性休克左心室急性心肌梗死。正常值指参考临界值
联合超声检查法
对脾脏进行联合多普勒评估,可从根本上区分两种主要病因(原发性灌注不足--左心室 CSAMI 或原发性充血导致灌注不足--CS-ADHF--图 1),从而帮助个体化治疗,及早识别和处理终末器官功能障碍,并可能改善临床预后。
未来展望
在过去几年中,人们提出了心脏、肺部和脾脏超声联合方法来识别不同阶段的充血。然而,目前仍完全缺乏与心血管疾病不同病因/表型和疾病分期(CS-SCAI 分期)的关联。根据心血管表型验证不同的模式是研究的当务之急。此外,ADHF 是一种 "连续 "综合征,导致 CS 的急性失代偿发生的时间跨度不可预测,并有可能迅速演变为器官衰竭。研究的重要目标之一是确定如何截断休克前期,并根据临床和超声波征象对其进行定性。由于大多数 ADHF 患者都由心力衰竭心脏病专家随访,这一过程需要 ICU 和心力衰竭专家之间进行严格的多学科交流,以建立结构化的合作网络和随访,这将不可避免并幸运地实现生理病理知识和方法的互补共享。早期充血的特点是 RDRI 和静脉断流正常,PVPI 正常,脾脏体积增大,SRI 初期增高。CS-ADHF 的特征是所有电阻率指数(肾脏和脾脏)增加,静脉区的搏动性增加。此外,根据早期 SCAI,脾脏可能有不同的尺寸(SCAI B 中的博格-儿茶酚胺激增时无交感神经激活;SCAI C-E 中对α和β受体激活有反应)。
CS LV AMI 的特点是阻力指数增加,脾脏容量减少,这与交感神经激活将血液从储血器中移出以优化前负荷和增加每搏容量有关。由于没有充血,PVPI 正常。


