Circulation 武汉大学王琰课题组揭示PCSK9调节血脂水平作用机制
时间:2025-03-15 12:08:22 热度:37.1℃ 作者:网络
我国心血管疾病患者超过3亿,死亡人数占据总死亡人数的近50%。低密度脂蛋白(LDL)胆固醇是诱发心血管疾病的主要风险因素,统计发现每增加1mg/dL的LDL胆固醇,冠心病的发病率增加大约1%, 当前的临床指南以及心血管疾病的治疗药物几乎全部以降LDL胆固醇为首要目标1。
PCSK9是肝脏分泌因子,人类遗传学研究发现其功能失活突变显著降低血清胆固醇水平,降低冠心病发病率80%以上,且PCSK9基因缺失个体身体健康2-4。这些证据快速推动临床转化,已有三种PCSK9抑制剂获批进入临床,成为新一代强效降血脂药物,并于去年纳入我国医保,目前仍有50余种抑制剂处于临床试验阶段5。王琰课题组在前期研究中发现,PCSK9与肝脏细胞表面LDL受体直接结合,促进其至溶酶体降解,且不依赖所有已知蛋白降解通路6,7。PCSK9如何调节LDL受体的降解以调节血脂水平长期困扰领域同行。同时,随着PCSK9药物在临床中的大量使用,其药物抵抗问题逐渐显露,而背后的分子基础完全未知。
2025年3月12日,武汉大学生命科学学院、泰康生命医学中心王琰课题组在Circulation上发表题为“PCSK9 promotes LDLR degradation by preventing SNX17-mediated LDLR recycling”的研究论文,阐明了PCSK9促进LDL受体降解的作用机制,揭示了PCSK9药物抵抗的发生基础。

该研究发现,内吞体的酸性pH值诱导LDLR胞外区段发生构象折叠,进而招募SNX17与其胞内区段“NPxY”功能区结合,发生主动分选与循环。肝脏SNX17的基因缺失导致LDLR在内吞体中滞留,随着内吞体的酸化与成熟,最终被溶酶体降解。PCSK9通过与LDLR胞外区段的直接结合阻断酸性pH诱导的LDLR构象变化,阻断LDLR与SNX17的结合,导致LDLR与PCSK9复合体在内吞体中滞留,并最终被溶酶体降解。任何影响LDLR构象变化的突变体均对PCSK9及其抑制剂产生抵抗,并在PCSK9药物抵抗病人中发现新的该类型突变。
LDLR是机体清除LDL的最主要方式,这一成果不仅对理解胆固醇代谢平衡具有重要生理意义,也将为PCSK9药物抵抗与精准用药提供临床指导。泛素化-蛋白酶体、自噬-溶酶体等已知蛋白降解通路往往需要对目标蛋白进行标记,或借助特定识别受体进行分选,该研究发现PCSK9仅通过影响LDLR构象变化即可决定其命运,提出膜蛋白降解调控新方式。人类基因组编码一千余种I型膜蛋白,大部分会发生内吞与循环,并伴随pH诱导的构象变化,这一新的调控方式对理解其它I型膜蛋白的降解调控将具有重要借鉴意义。
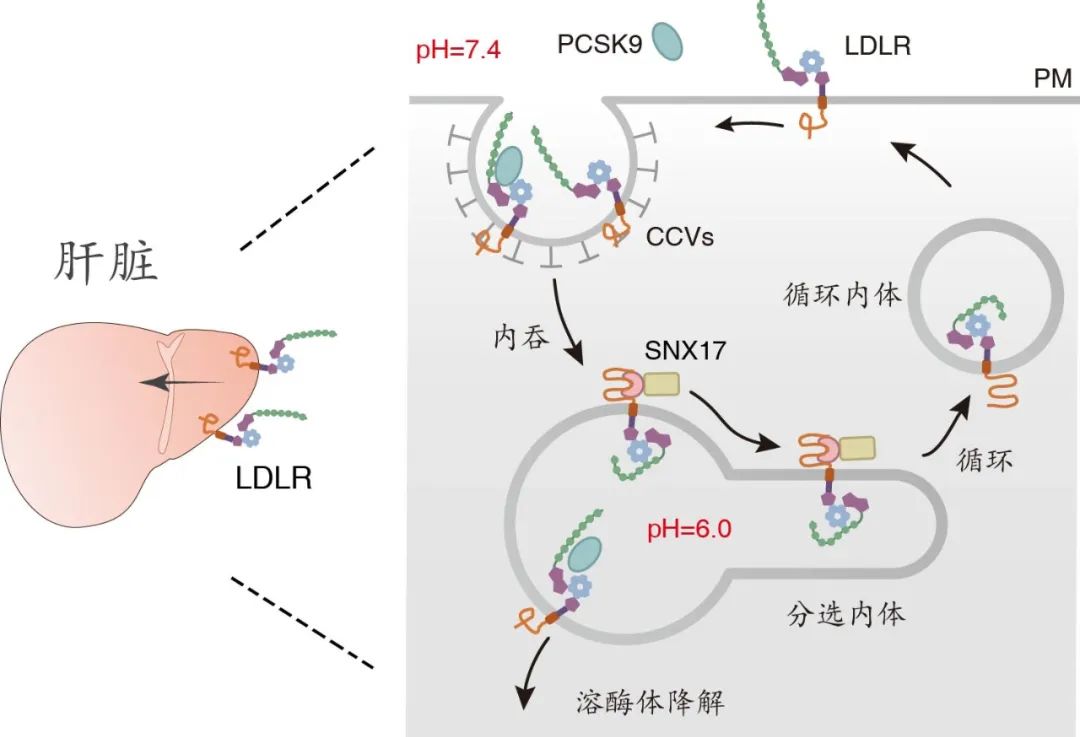
PCSK9调节LDLR降解示意图
武汉大学生命科学学院博士生官阳阳、刘小民、中南医院心外科医生杨泽天为论文共同第一作者,王琰教授为通讯作者。武汉大学宋保亮院士、刘勇教授、罗婕教授、首都师范大学潘晓伟教授、香港科技大学郭玉松教授、南方科技大学饶枫教授为本研究提供重要帮助。该课题受到国家自然科学基金委、科技部、武汉大学的经费与科研平台支持。
课题组主页:
https://bio.whu.edu.cn/info/1498/9421.htm
论文链接:
https://doi.org/10.1161/CIRCULATIONAHA.124.072336
参考文献:
1. Prospective Studies, C. et al. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet 370, 1829-1839, doi:10.1016/S0140-6736(07)61778-4 (2007).
2. Abifadel, M. et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nature genetics 34, 154-156, doi:10.1038/ng1161 (2003).
3. Cohen, J. C., Boerwinkle, E., Mosley, T. H., Jr. & Hobbs, H. H. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. The New England journal of medicine 354, 1264-1272, doi:10.1056/NEJMoa054013 (2006).
4. Zhao, Z. et al. Molecular characterization of loss-of-function mutations in PCSK9 and identification of a compound heterozygote. American journal of human genetics 79, 514-523, doi:10.1086/507488 (2006).
5. Al Rifai, M. & Ballantyne, C. M. PCSK9-targeted therapies: present and future approaches. Nature Reviews Cardiology 18, 805-806, doi:10.1038/s41569-021-00634-0 (2021).
6. Fu, T., Guan, Y., Xu, J. & Wang, Y. APP, APLP2 and LRP1 interact with PCSK9 but are not required for PCSK9-mediated degradation of the LDLR in vivo. Biochimica et biophysica acta. Molecular and cell biology of lipids 1862, 883-889, doi:10.1016/j.bbalip.2017.05.002 (2017).
7. Wang, Y., Huang, Y., Hobbs, H. H. & Cohen, J. C. Molecular characterization of proprotein convertase subtilisin/kexin type 9-mediated degradation of the LDLR. Journal of lipid research 53, 1932-1943, doi:10.1194/jlr.M028563 (2012).


