Nature子刊发文-肠道菌群与抑郁症:藏在肚子里的"情绪开关"被破解了?
时间:2025-03-06 12:23:57 热度:37.1℃ 作者:网络
抑郁症作为一种常见且严重的精神障碍,给全球众多患者带来沉重负担。传统观点多聚焦于神经递质失衡、神经内分泌异常等因素对抑郁症的影响。近年来,随着微生物学、免疫学和神经科学等多学科的交叉发展,肠道菌群与抑郁症的联系已成为研究热点。
抑郁患者肠道菌群与健康人存在显著差异
肠道菌群是由数万亿微生物组成的"人体第二基因组",其细胞数量达人体自身细胞的10倍,编码的基因超过100万个。研究发现,肠道菌群可以通过脑肠轴与我们的大脑进行信息交流,进而影响我们的情绪。
越来越多的研究表明,与健康人相比,抑郁症患者的肠道菌群组成发生了显著差异。尽管研究结果存在差异,但抑郁症患者肠道中促炎细菌的富集和抗炎细菌的减少是被普遍发现的,进一步支持了抑郁症的炎症假说。2024年,一项发表在Nature Communications的研究,对 85 例首发、未用药的抑郁症患者(MDD)和 85 例健康对照(HC)进行研究,发现 MDD 患者的肠道微生物多样性和组成发生改变,如毛单胞菌科、红螺菌科相对丰度增加,而梭菌科、消化链球菌科等减少;在属水平上,MDD 患者中阿德勒克雷茨菌相对丰度显著升高,梭菌属、罗斯氏菌属等则明显降低。通过相关性分析还发现,梭菌属、罗斯氏菌属等与丙酸、丁酸水平呈正相关,与超敏 C 反应蛋白(hs - CRP)和抑郁症状评分(HAMD - 17)呈负相关。这意味着当抗炎菌(如梭菌属)、罗斯氏菌属等的含量降低时,抑郁症状评分会升高,即抑郁症状可能更严重。
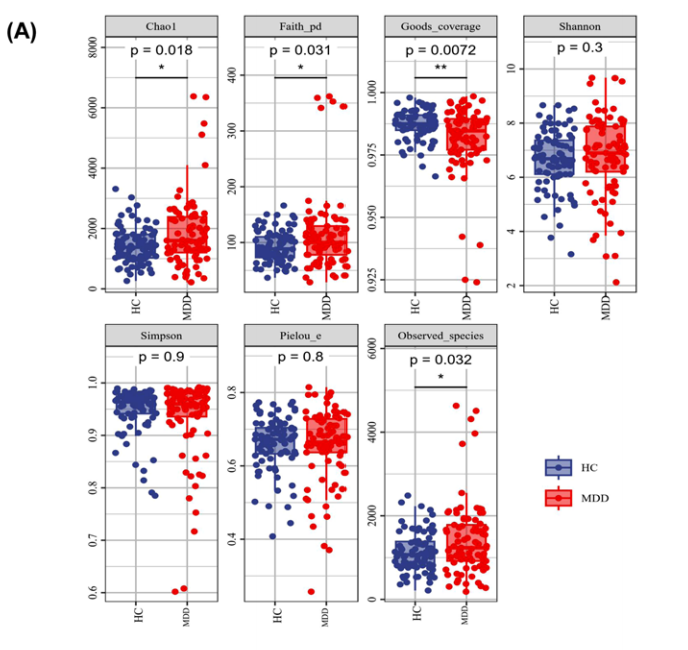
alpha多样性分析显示:MDD患者的Chao指数、Faith的系统发育多样性高于健康人,MDD患者的良好覆盖率较低(P < 0.05)
肠道菌群影响抑郁症的机制研究
该研究还表明,肠道菌群紊乱与炎症性抑郁症的发生密切相关。在炎症性抑郁症患者中,肠道菌群平衡被打破,促炎菌如拟杆菌科和拟杆菌属相对丰度显著增加,而抗炎菌如梭菌科和梭菌属则明显减少。这种菌群结构的改变,会激活 Toll 样受体 4(TLR - 4)/ 核因子 κB(NF - κB)和 NLRP3 介导的炎症级联反应。
具体来说,肠道菌群紊乱导致肠道黏膜炎症因子如 TLR - 4、NF - κB、NLRP3 等表达升高。这些炎症因子的上调会进一步破坏肠道黏膜屏障,使肠道黏膜通透性增加。此时,原本被肠道屏障阻挡的细菌及其代谢产物得以进入循环系统,从而激活全身免疫反应。血液中的炎症因子水平随之升高,它们可以通过血液循环或神经通路进入大脑,影响大脑神经炎症。神经炎症会干扰神经递质的合成、释放和代谢,导致神经递质失衡,如血清素、多巴胺等神经递质水平下降,进而影响大脑的正常功能,最终导致抑郁症状的出现。
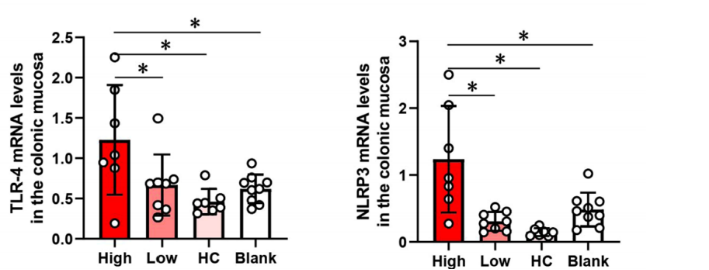
高炎症组的炎症因子升高(TLR-4,NLRP3在肠道黏膜中表达升高)
此外,一项发表在Nature Immunology(IF=27.7)的研究发现,长期压力(慢性社会挫败应激小鼠模型)会致使肠道菌群中的乳酸菌大量减少,引发肠道γδT细胞的增殖/分化,并迁移至大脑,进而引发抑郁神经行为学的发生。
综上所述,肠道菌群对抑郁症的影响机制展现出高度的复杂性和多面性。从免疫调节到对肠道免疫细胞的调控,这些机制相互交织,共同影响着大脑的功能和行为表现。尽管目前的研究已经取得了显著进展,但仍有许多未知等待进一步探索。
益生菌对抑郁症的干预效果
基于肠道菌群与抑郁症的密切关联,益生菌作为一种潜在的治疗手段受到了广泛关注。Schaub 等人开展了一项随机对照试验,对患有当前抑郁发作的患者进行研究。患者在接受常规治疗的同时,分别服用多菌株益生菌补充剂或安慰剂 31 天。结果显示,在完成干预的样本中(益生菌组 N = 21,安慰剂组 N = 26),益生菌组的 HAM-D 评分随时间下降幅度更大,且益生菌能够维持微生物多样性,增加乳酸杆菌属的丰度,该属丰度的增加与抑郁症状的减轻相关。
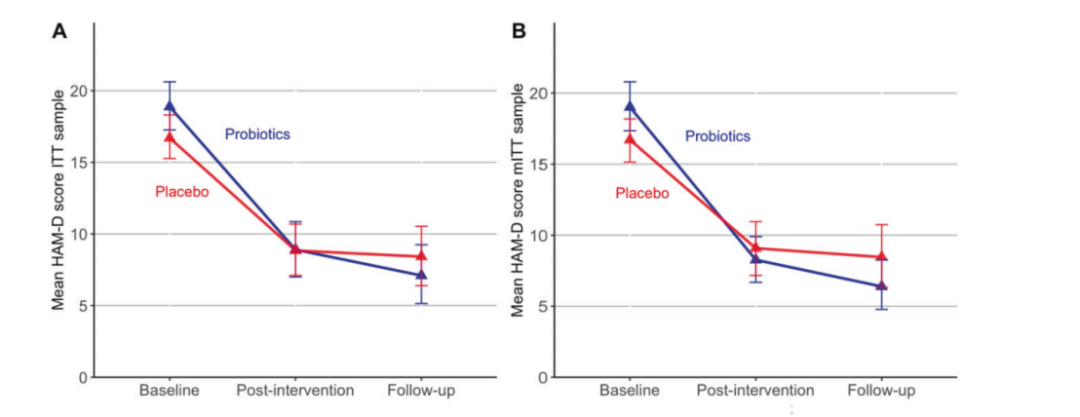
益生菌组和安慰剂组抑郁症得分变化
上述研究从不同角度深入探讨了肠道菌群与抑郁症之间的关系,为理解抑郁症的发病机制提供了新的视角,也为开发新的治疗方法提供了理论依据。然而,仍存在一些局限性。如研究中临床样本量较小。未来的研究需要进一步扩大样本量,开展更多高质量的临床研究。
参考文献:
1. Schaub AC, Schneider E, Vazquez-Castellanos JF,et al. Clinical, gut microbial and neural effects of a probiotic add-on therapy in depressed patients: a randomized controlled trial. Transl Psychiatry. 2022 Jun 3;12(1):227. (IF=6.2)
2. Zhu X, Sakamoto S, Ishii C, et al. Dectin-1 signaling on colonic γδ T cells promotes psychosocial stress responses. Nat Immunol. 2023 Apr;24(4):625-636.(IF=27.7)
3.Liu P, et al. Immunoregulatory role of the gut microbiota in inflammatory depression. Nat Commun. 2024 Apr 8;15(1):3003. doi: 10.1038/s41467-024-47273-w.(IF=14.7)


