感染通鉴录 | 当碎石术遇上"铜墙铁壁"菌,这场攻坚战如何破局?
时间:2025-02-16 12:10:06 热度:37.1℃ 作者:网络
当前,感染性疾病的复杂性和多样性不断加剧,给临床医生带来了更大的挑战。为了应对这一挑战,加强学术交流、提升临床诊疗水平变得尤为重要。
为此,“感染前沿”携手“南通市第三人民医院感染科”共同推出--“感染通鉴录”病例分享专栏。旨在通过分享各类感染病例,帮助广大医务工作者及时了解和掌握最新的感染病诊疗技术和经验,促进学术交流与合作,共同提升对感染性疾病的诊疗能力,为患者提供更加精准、有效的治疗。
钬激光碎石术后并发耐碳青霉烯肺炎克雷伯菌血流感染、肾脓肿1例
尿石症是临床常见病之一,近年来,随着微创技术的发展,膀胱镜、输尿管软镜、经皮肾镜等联合钬激光已成为处理尿路结石的重要手段之一。
虽然内镜微创技术使出血、穿孔等手术风险有所降低,但是,术后感染的风险却没有降低,特别是脓毒症已成为术后主要的并发症之一,而脓毒败血症性休克及其引起的多器官衰竭是导致患者死亡的重要因素[1-3]。
我科收治一例钬激光碎石术后并发脓毒症的重症患者,现报告如下。
一、病史简介
现病史
患者男性,56岁,因“钬激光碎石术后间断发热17d”入院。
患者入院前1月多来反复出现尿频、尿不尽、血尿,B超检查提示膀胱结石(直径23mm),尿常规提示白细胞2+,在某院行经尿道膀胱镜下钬激光碎石术,术后出现排尿困难并于次日行尿管留置,6天后拔除导尿管,当天患者出现发热,Tmax 39.5℃,伴有畏寒寒战,至该院急诊就诊,查血常规白细胞7.9×109/L,中性粒细胞92.3%,超敏C反应蛋白(C-reaction protein,CRP)82mg/L,尿常规:隐血2+,蛋白+,白细胞681/ul,白细胞镜检124/HP,给予头孢米诺静滴抗感染后体温正常。
入院前1d患者夜里再次出现发热,体温>39℃,伴畏寒寒战,至我院急诊就诊,急查血常规白细胞7.68×109/L,中性粒细胞89.5% ,超敏CRP 142mg/L,降钙素原(Procalcitonin,PCT)44.69ng/ml,尿素氮11.68mmol/L,肌酐214.8μmol/l,给于头孢他啶经验性抗感染治疗,并为进一步诊治收入我科。
既往史
有高血压病史5年,最高180/120mmHg,平素不规律服用药物,血压控制一般;2019年7月有脑左侧基底节出血病史,遗留轻度右侧肢体功能障碍、轻度语言障碍,平时生活能自理;有白细胞减少病史约3年,平素白细胞1-2×109/L。
体格检查
T 39.8℃,BP 150/80mmHg,HR 124次/分,R 30次/分,神志清,精神萎,浅表淋巴结未触及明显肿大,两肺呼吸音清,未闻及明显干湿啰音,心律齐,各瓣膜听诊区未闻及杂音,腹平软,无明显压痛及反跳痛,右肾区叩击痛(+),双下肢无水肿,右侧肢体肌力3级,左侧肢体肌力5级。
入院诊断
脓毒症,泌尿道感染,急性肾功能不全,原发性高血压(3级 很高危),脑出血后遗症期。
辅助检查
血常规:白细胞7.68×109/L,中性粒细胞89.5%,血红蛋白98g/L,血小板110×109/L;
PCT:44.69ng/ml;
超敏CRP:142mg/L;
铁蛋白:>2000ng/ml;
凝血功能:凝血酶原时间17.7S,纤维蛋白原4.59g/L,D二聚体8.73mg/L;肝功能:谷丙转氨酶22U/L,总胆红素48μmol/L,乳酸脱氢酶524U/L,γ谷氨酰转肽酶172U/L,白蛋白35.5g/L,球蛋白36.9g/L,肌酸激酶321U/L;肾功能:尿素氮11.68mmol/L,肌酐214.8μmol/l;
葡萄糖6.0mmol/l;糖化血红蛋白6.1%;
血气分析:PH 7.463,二氧化碳分压30.5mmHg,氧分压70.4mmHg,碱剩余-3.3,乳酸2.2mmol/L;
B型利钠钛318pg/ml;
尿常规:隐血3+,白细胞2+,蛋白2+,红细胞38/μL,白细胞349/μL;
细胞免疫:淋巴细胞计数117/μL,总T淋巴细胞计数84/μL,CD4+T淋巴细胞48/μL,CD8+T淋巴细胞31/μL,B淋巴细胞计数11/μL,NK细胞计数23/μL;
感染四项、肿瘤标志物:阴性;
胸部CT、心超、心电图未见明显异常。
二、诊治经过
入院后计算SOFA评分为7分,存在多脏器损伤,感染较重,经验性给予美罗培南抗感染,并留取血培养、尿培养。
治疗3天,患者仍持续高热,PCT、CRP进行性升高,血小板、白蛋白下降明显,给予白蛋白、丙种球蛋白支持治疗,行全腹部CT平扫:右肾体积明显增大,包膜下少许积气,右肾囊肿。
第5天,血培养(双侧双瓶)回报:肺炎克雷伯菌,药敏报告:四环素、氯霉素、复方新诺明敏感,β-内酰胺类/β-内酰胺酶抑制剂复方制剂、碳青酶烯类、氟喹诺酮类、氨基糖苷类抗生素均耐药(见图1),改头孢他啶-阿维巴坦1.25 q8h(根据肾小球滤过率减半使用)+磷霉素8g q8h联合抗感染治疗,随访PCT、CRP逐渐下降。
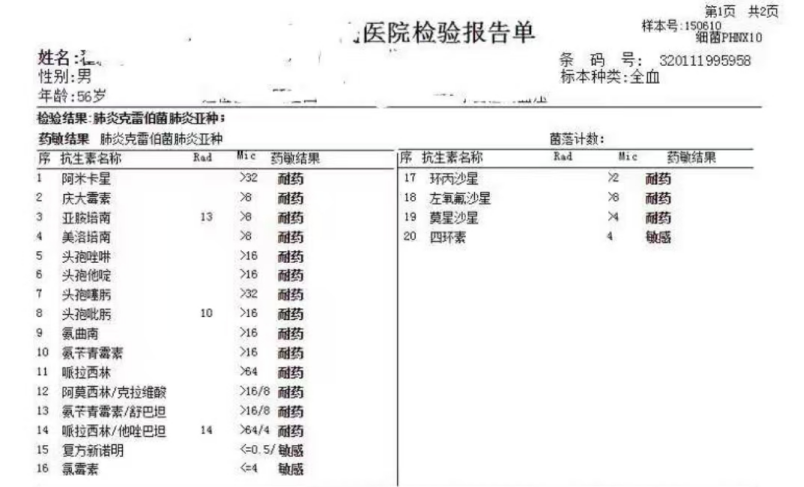
图1 血培养:肺炎克雷伯菌肺炎亚种 备注:CRKP
第7-8天,患者出现腹胀,解柏油样便、呕吐咖啡样物,查血淀粉酶、脂肪酶增高,粪隐血、呕吐物隐血阳性,血红蛋白61g/L,考虑并发胰腺炎、上消化道出血,给于禁食、抑酸止血、输血等治疗后出血停止。
第9天,患者出现右下腹痛伴腰痛明显,体温再次升高,床边B超提示右肾体积增大,回声减低,皮髓结构不清晰,右侧输尿管上段扩张,中下段显示不清,右肾囊肿,右肾肾周少量积液,胰腺回声略增粗,腹水。
考虑患者存在右侧输尿管梗阻可能,行CTU增强检查,结果提示:1.考虑右肾炎症伴多发脓肿形成(局部少量出血),累及中上段输尿管、周围广泛渗出,不除外合并损伤及梗塞;2.肝脾肿大;3.两侧少量胸腔积液伴两肺下叶部分膨胀不全;心包少量积液;腹盆腔少量积液;三维重建右肾不显影(见图2)。考虑感染极重,头孢他啶-阿维巴坦用至足量2.5g q8h,继续联合磷霉素抗感染。
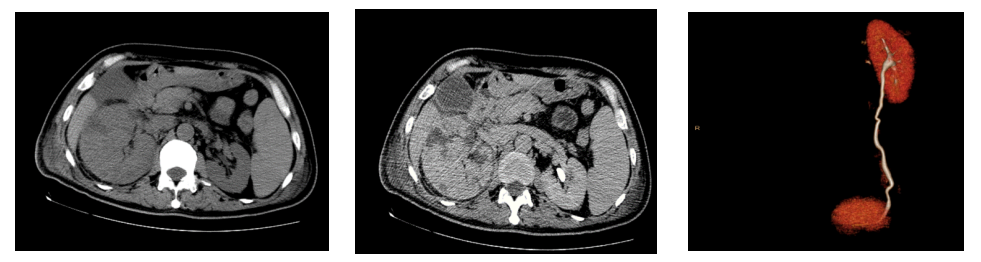
图2 CTU平扫+增强+三维重建:右肾炎症伴多发脓肿形成(局部少量出血)
经积极治疗后患者热峰下降,生命体征稳定,连续两次血培养阴性,复查血常规:白细胞6.60×109/L,中性粒细胞百分比90.8%,红细胞2.10×1012/L,血红蛋白66g/L,血小板167×109/L,超敏CRP 160.71mg/L,PCT 1.68ng/ml,肾功能:尿素氮8.67mmol/L,肌酐130.6μmol/L。
感染明显控制,肾功能改善,病情好转出院至原手术医院泌尿外科行右肾脓肿手术治疗。
三、讨论
微创内镜钬激光碎石术后导致尿源性脓毒症的发病原因可能为:术前存在尿路感染、结石内包裹有病原菌、手术时间过长、术中冲洗液体灌注压力过高、术后引流不畅、患者免疫力低下等[2-3]。
本例患者有高血压、脑出血、白细胞减少病史,入院后查CD4+T淋巴细胞仅为48/μL,为严重免疫低下人群,术前有尿路刺激征,尿白细胞升高,但术前未进行尿培养及有效的抗感染治疗,术后出现尿路梗阻、尿路感染,抗感染不充分,各种因素参与下最终导致了尿源性脓毒症,且病原菌为CRKP。
近年来,随着广谱抗菌药物的广泛使用,肺炎克雷伯菌的检出率及其对碳青霉烯类药物的耐药率显著增加[4]。2018年CHINET中国细菌耐药监测数据显示[5],肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%上升到了2018年的25.0%和26.3%,耐药率上升幅度超过8倍,且其在革兰阴性杆菌中的检出率占比亦呈逐步上升趋势。从8274株碳青霉烯类耐药肠杆菌科细菌菌株的分布看,分离率前三位的依次是肺炎克雷伯菌(68.6%,5673/8274)、大肠埃希菌(10.8%,896/8274)和阴沟肠杆菌(6.9%,568/8274),CRKP的检出率显著高于其他革兰阴性杆菌。
CRKP不仅检出率越来越高,而且其所致感染病死率高。据国外某医院研究显示,CRKP引起的血流感染相对于敏感菌株具有较高的死亡率(48%比17%),碳青霉烯耐药是死亡的独立预测因子[6]。中性粒细胞减少患者感染CRKP,14天死亡率高达50%,其中持续性中性粒细胞减少、脓毒性休克、单药治疗是死亡的独立危险因素[7]。CRKP的治疗已成为当下临床抗感染的难题之一。
CRKP感染可供选择的抗菌药物很少,目前常用的有替加环素、多粘菌素类、碳青霉烯类、氨基糖苷类、头孢他啶-阿维巴坦、磷霉素等,但临床研究显示单药治疗失败率高,通常采用2种或3种药物联合[8]。
本例患者为CRKP引起的血流感染、多发性肾脓肿,伴有肾功能损害,病情危重,由于替加环素组织分布广,血药浓度低,故未选用;多粘菌素类包括多黏菌素B及多黏菌素E,对各类耐药革兰阴性杆菌具有良好体外抗菌活性,但有明显的肾毒性[9],故未选用;氨基糖苷类同样因肾损害未选用。
碳青霉烯类用于治疗CRKP感染应符合以下条件:①最低抑菌浓度(MIC)≤8mg/L,②大剂量给药(如美罗培南,2g q8h),③延长静脉滴注时间(每剂2~3h)[10,11] ,该患者药敏显示美罗培南MIC>8mg/L,且初始临床治疗无效,故亦未作为联合用药。
头孢他啶-阿维巴坦系头孢他啶与一种新型β内酰胺酶抑制剂(阿维巴坦)组成的复方制剂,阿维巴坦与克拉维酸、舒巴坦、他唑巴坦等传统β-内酰胺酶抑制剂不同,后者通常只能抑制A类β-内酰胺酶,而阿维巴坦体外可抑制A类、C类和某些D类β-内酰胺酶,因此抑酶谱更广。
另外,传统β-内酰胺酶抑制剂属于不可逆性自杀性酶抑制剂,其与β-内酰胺酶竞争性结合形成稳定的非共价复合物后,自身结构也被破坏;而阿维巴坦不含β-内酰胺环,且与β-内酰胺酶共价结合时发生的酰化反应可逆,自身结构及活性可经逆反应恢复, 因此具有长效抑酶作用[12,13]。
一项多中心研究[14]回顾分析了104例CRKP血流感染患者在应用其他一线抗菌药物进行治疗(治疗时间中位数:7天)无效后开始的头孢他啶-阿维巴坦挽救治疗,结果显示,头孢他啶-阿维巴坦治疗者的30天死亡率明显低于非头孢他啶-阿维巴坦治疗者(36.5% vs. 55.7%,p=0.005),在接受单药挽救治疗方案的患者中,头孢他啶-阿维巴坦组的30天死亡率显著低于其他单药方案组(9/22,40.9% vs. 21/27,77.8%,p=0.008),头孢他啶-阿维巴坦是生存的唯一独立预测因子。磷霉素抗菌作用较弱,但其独特的结构和抗菌作用机制,与其他抗菌药物无交叉耐药性,与头孢他啶-阿维巴坦联合在体外对CRKP表现为协同作用[15]。
本例患者为CRKP,在最初使用碳青霉烯类治疗无效的情况下,改用头孢他啶-阿维巴坦联合磷霉素治疗,患者的临床症状及实验室指标均有明显改善,感染控制良好。这个案例提示头孢他啶-阿维巴坦联合磷霉素可以作为临床治疗CRKP的抗菌方案之一。
参考文献
[1]Li K,Liu CL,Zhang XL. Risk Factors for Septic Shock After Mini-percutaneous Nephrolithotripsy With Holmium Laser[J]. UROLOGY,2013,81(6):1173-1176.
[2]邱涛,李鸣,唐矛.软输尿管镜激光碎石致败血症休克原因分析[J].中华腔镜外科杂志(电子版),2014,7(1):41-43.
[3] Senocak C, Ozcan C, Sahin T,et al.Risk Factors of Infectious Complications after Flexible Uretero-renoscopy with Laser Lithotripsy[J].Endourology and Stone Diseases,2018,15(4):158-163.
[4]吴佳晋,应亮,李大伟,等.肾移植供体来源耐药肺炎克雷伯杆菌感染13例救治经验[J]. 实用器官移植电子杂志, 2018 ,6 (1):9-12.
[5]胡付品,郭燕,朱德妹,等.2018 年CHINET中国细菌耐药性监测[J].中国感染与化疗杂志, 2020,20 (1):1-10.
[6]Ben-david D,Kordevani R,Keller N,et al.Outcome of carbapenem resistant Klebsiella pneumoniae bloodstream infections[J].Clin Microbiol Iinfect,2012,18(1) : 54-60.
[7]Tofas P,Skiada A,Angelopoulou M,et al.Carbapenemase-producing Klebsiella pneumoniae bloodstream infections in neutropenic patients with haematological malignancies or aplastic anaemia: Analysis of 50 cases[J].International Journal of Antimicrobial Agents,2016,47( 4) : 335-339.
[8]王明贵.广泛耐药革兰阴性菌感染的实验诊断、抗菌治疗及医院感染控制:中国专家共识[J].中国感染与化疗杂志, 2017,17(1):82-92.
[9] Cai Y,Chai D,Wang R,et al.Colistin resistance of Acinetobacter baumannii:
clinical reports,mechanisms and antimicrobial strategies [J].J Antimicrob Chemother,2012,67(7):1607-1615.
[10] Tumbarello M,Trecarichi EM,De Rosa FG,et al. Infections caused by KPC-producing Klebsiella pneumoniae: differences in therapy and mortality in a multicentre study[J]. J Antimicrob Chemother,2015,70(7):2133-2143.
[11] Daikos GL,Markogiannakis A. Carbapenemaseproducing Klebsiella pneumoniae :(when)might we still consider treating with carbapenems?[J]. Clin Microbiol Infect,2011,17,(8):1135-1141.
[12] Macvane SH, Crandon JL, Nichols WW, et al.In Vivo efficacy of humanized exposures of Ceftazidmine-Avibactam in comparison with Ceftazidime against contemporary Enterobacteriaceae isolates[J].Antimicrob Agents Chem other,2014,58(11):6913-6919 .
[13]Ehmann DE,Jahic H,Ross PL,et al. Kinetics of Avibactam Inhibition against Class A, C,and D beta-Lactamases [J].J Biol Chem,2013,28(39):27960-27971.
[14] Tumbarello M,Trecarichi E M,Corona A,et al.Efficacy of Ceftazidime-Avibactam Salvage Therapy in Patients With Infections Caused by Klebsiella pneumoniae Carbapenemase-producing K. pneumoniae [J]. Clin Infect Dis,2019 Jan 18;68(3):355-364.
[15] 陈涛,徐晔,董郭枫,等.头孢他啶/阿维巴坦单独和联合磷霉素碳青霉烯类耐药革兰阴性菌体外抗菌活性研究[J].检验医学, 2020,35(10):988-993.


