Cell:重磅突破!北大陈鹏等团队开发新型免疫疗法靶向嵌合体,有望治疗实体瘤
时间:2025-02-16 12:09:12 热度:37.1℃ 作者:网络
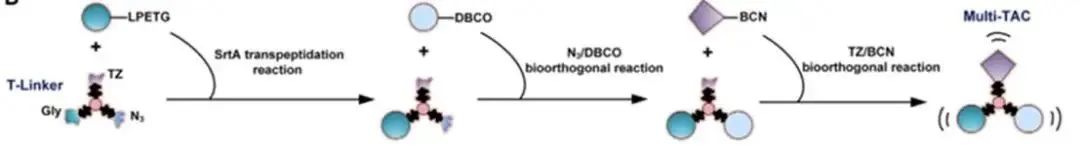
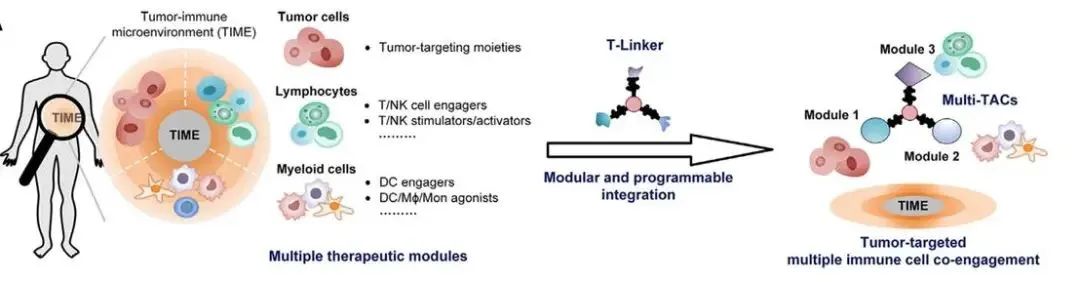
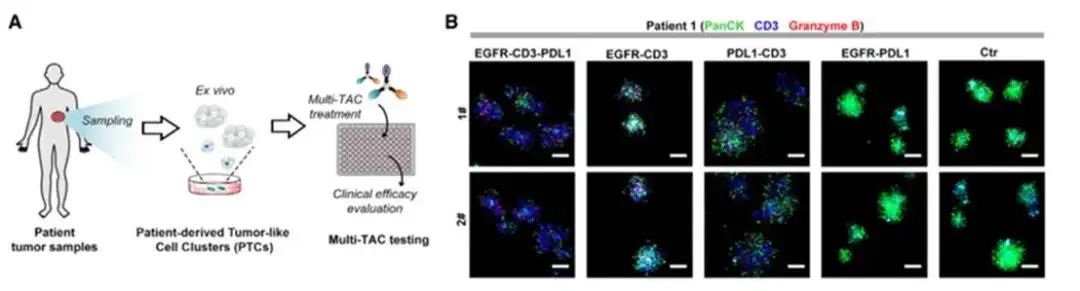
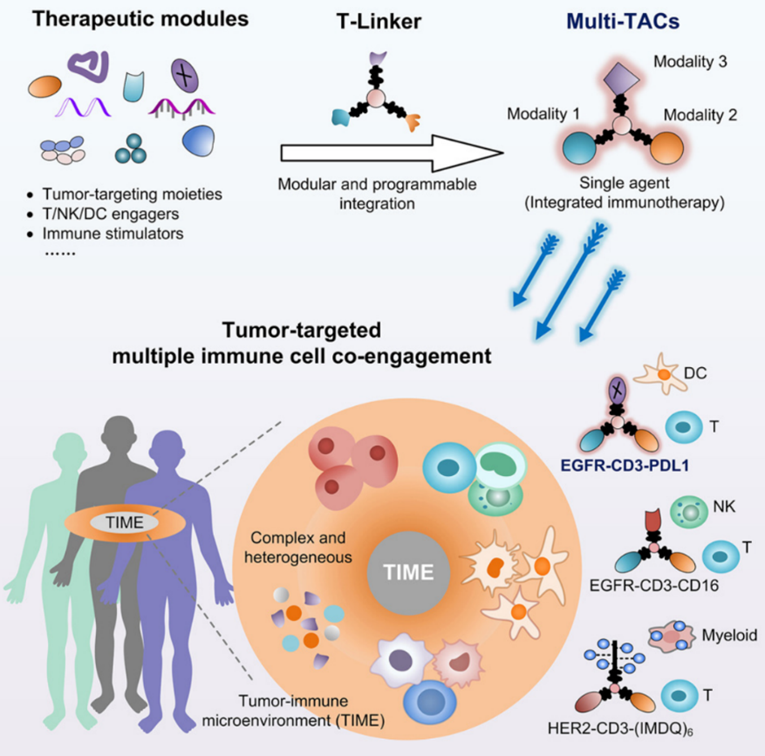
免疫疗法在癌症治疗中取得了显著进展,但仍存在一些问题。大多数免疫疗法仅针对特定类型的液体肿瘤有效,对大多数实体瘤的疗效并不理想。肿瘤免疫微环境(TIME)的复杂性和异质性是影响免疫疗法效果的重要因素,多种免疫细胞在其中发挥着重要作用。目前的双特异性或多特异性抗体大多存在一些局限性,如仅能靶向单一类型免疫细胞、牺牲肿瘤靶向性、安全性问题等。 2024年11月5日,由北京大学、北大-清华生命科学联合中心陈鹏教授领衔的科研团队,联合国内多位学者(北京大学席建忠教授、中国医学科学院肿瘤医院康晓征教授、南京大学李颜教授以及北京大学第三医院林坚研究员),在Cell杂志在线发表了题为“Multimodal targeting chimeras enable integrated immunotherapy leveraging tumor-immune microenvironment”的研究论文。该研究创新性地开发了基于三重正交偶联臂(T-Linker)的一种多模态靶向嵌合体(Multi-TACs)平台,通过三种相互正交的化学反应,实现了抗体、小分子、多肽等不同治疗模块的位点特异性与高效整合,实现同时招募实体瘤微环境中的多种免疫细胞,显著提高了免疫治疗的效果。 研究人员通过筛选和优化,选择了三种相互正交的高效偶联反应:DBCO与叠氮的点击化学反应、BCN与四嗪的逆电子需求Diels-Alder反应,以及转肽酶SrtA介导的转肽反应。这些反应模块相互独立,能够在同一平台上同时整合三种不同的药物模块,形成多模态靶向嵌合体(Multi-TAC)。 基于T-linker平台,研究人员设计了三类靶向模块,以实现对肿瘤免疫微环境的全面调控: 1. 淋巴细胞招募模块:通过结合anti-CD3、anti-CD16/NKG2D和CMV肽段等,招募T细胞和NK细胞等淋巴细胞,增强免疫反应。 2. 髓细胞招募模块:利用anti-PDL1和髓细胞上toll-like受体的激动剂等,招募髓细胞,调节免疫微环境。 3.肿瘤细胞靶向模块:通过EGFR和HER2等肿瘤高表达蛋白的抗体分子,精准靶向肿瘤细胞。 以EGFR-CD3-PDL1 Multi-TAC为例,研究人员在体外实验中验证了其功能。实验结果显示,该多模态靶向嵌合体能够显著增强T细胞的免疫反应,诱导T细胞分泌多种炎症因子,如IFN-γ和颗粒酶B。与传统的双特异性嵌合体相比,Multi-TAC的抗肿瘤效果提升了2-4倍。 在体内实验中,研究人员使用人源PBMC和HSC免疫细胞群构建了多种人源化小鼠模型,测试了Multi-TAC的治疗效果。结果表明,EGFR-CD3-PDL1 Multi-TAC能够显著抑制肿瘤生长,并重塑肿瘤免疫微环境。特别是在转基因人源化小鼠模型中,该多模态靶向嵌合体几乎彻底消灭了肿瘤,并诱导了小鼠体内的肿瘤特异性免疫记忆。 此外,研究人员还在多种临床肿瘤患者样本中评估了Multi-TAC的疗效。在非小细胞肺癌(NSCLC)患者样本中,EGFR-CD3-PDL1 Multi-TAC的有效率高达86%,显著优于目前临床上广泛使用的PD-1/PD-L1检查点抑制剂pembrolizumab。 这项研究开发的多模态靶向嵌合体平台为肿瘤免疫治疗提供了一种全新的思路。该平台不仅能够同时靶向多种免疫细胞,还具有高度的模块化和广谱适应性,可以针对不同的肿瘤微环境实现灵活的免疫调控。未来,随着更多靶向模块的开发和优化,Multi-TAC有望在多种实体瘤的治疗中发挥重要作用,为癌症患者带来新的希望。 

通讯作者介绍

陈鹏 教授
陈鹏教授现任北京大学化学与分子工程学院研究员、北大-清华生命科学联合中心及北京大学合成与功能生物分子中心研究员,博士生导师,国家杰出青年科学基金获得者。作为化学生物学与蛋白质化学领域的领军学者,他致力于通过化学手段推动生命科学前沿研究。
陈教授2002年本科毕业于北京大学化学学院,后赴美国芝加哥大学深造,2007年获化学博士学位。曾在Scripps研究所和诺华制药从事博士后研究,2009年回国加入北大任教。其研究聚焦四大方向:蛋白质工程与药物化学、病原菌-免疫系统互作机制、活体内化学反应技术、生物传感器开发。他创新性地将钯介导反应应用于活细胞蛋白质标记,相关成果发表于Nature Chemistry等顶级期刊。
学术荣誉方面,陈教授先后获得中国青年科技奖(2013)、药明康德生命化学奖(2011)、英国皇家化学会Emerging Investigator Lectureship(2014)等十余项国内外奖项。主持国家自然科学基金杰青项目,入选首批中组部"青年拔尖人才"计划。担任《化学生物学学科前沿与展望》等多部学术专著主编,在Nature子刊、JACS等国际顶级期刊发表论文50余篇,单篇最高引用超300次。
陈鹏教授团队开发的蛋白质标记技术为疾病机理研究提供了重要工具,其关于大肠杆菌铜感应机制的研究被Nature China作为亮点报道。目前课题组聚焦蛋白质动态修饰与精准调控,致力于推动化学工具在生物医学中的应用转化。

席建忠 教授
席建忠教授现任北京大学未来技术学院教授、博士生导师,国家杰出青年基金获得者,教育部长江特聘教授,重点研发项目首席科学家。1996年毕业于北京理工大学化工与材料学院,2000年在清华大学生物系获得细胞与分子生物学硕士,2004年在美国加州大学洛杉矶分校获得生物医学工程专业博士学位。
席建忠教授主要从事肿瘤精准医学、基因编辑、生物芯片等研发及应用。他开发了自组装细胞芯片等一系列适合高通量功能组学研究的新技术,揭示了肝脏分泌的TGFβ1影响心脏收缩节律的分子机制,还研发出微肿瘤芯片,药敏预测临床准确性达90%以上。他在Nature、Nature Biotechnology等专业杂志发表90余篇高水平学术论文,申报10项国家发明专利,其中4项授权。
席建忠教授还担任中国医药生物技术协会基因检测分会副主任、中国化学会化学生物学专业委员会委员等职务,并是Science、JACS等国际知名杂志的审稿人。

康晓征 教授
康晓征教授现任中国医学科学院肿瘤医院胸外科副主任医师、医学博士。他毕业于北京大学医学部,获得医学博士学位,还曾公派至美国杜克大学医学中心研修微创胸外科技术,并在杜克大学癌症中心专注于癌症分子流行病学研究,北卡罗莱纳中央大学从事食管癌分子机制研究。
康教授在食管癌及食管胃交界部癌(贲门癌)的早期诊断、微创外科治疗、综合治疗等方面有丰富的经验。他擅长“免管免禁”食管外科加速康复、颈段食管癌外科治疗、“寡转移型”食管癌外科治疗等。此外,他还精通微创纵隔肿瘤外科治疗及复杂胸壁肿瘤外科治疗。
在学术领域,康教授担任中国临床肿瘤学会青年专家委员会秘书长兼常委,也是中国抗癌协会食管癌专业委员会青年委员。他参与编写了《中国可切除食管癌围手术期诊疗实践指南(2023版)》并担任共同执笔人。2023年,康教授荣获第三届“人民好医生·金山茶花”食管癌领域优秀典范奖。

李颜 教授
李颜教授现任南京大学医学院模式动物研究所所长、医药生物技术全国重点实验室研究员。他本科毕业于武汉大学生物技术专业,后赴新加坡攻读博士学位,2012年毕业于麻省理工学院-新加坡联盟。2012至2018年,他在法国巴斯德研究所免疫系完成博士后训练并担任助理研究员。2018年,李颜教授加入南京大学,致力于人源化小鼠模型的开发与应用。
李颜教授的研究成果发表于Cell、Nature Methods、Science Advances等国际知名期刊,并多次受邀在国际会议上作报告。他主持了多项国家级科研项目,包括国家重点研发计划青年首席项目,并获得国家自然科学基金“优青”、江苏省“双创团队领军人才”等荣誉。此外,他还担任国际人源化小鼠大会科学委员会成员,积极推动该领域的发展。

林坚 教授
林坚教授现任北京大学第三医院研究员、博士生导师,北京大学合成与功能生物分子中心兼职研究员,海南大学药学院兼职教授。他2004年在军事医学科学院获博士学位,2016年获得国家自然科学基金优秀青年基金。林坚研究员主要研究基于临床表观遗传学的疾病诊断、靶点发现与靶向药物开发。他主持国家及省部级课题8项,包括国家自然科学基金优秀青年基金、面上项目、青年项目、国家重大新药创制项目等。林坚研究员以第一作者或通讯作者在JACS、STTT等杂志发表高水平研究论文,其团队在猴痘疫苗方向取得重要进展,还发现了打开血迷路屏障的全新靶点。


