【论著】| 洛铂HIPEC联合最佳支持治疗腹腔转移癌的疗效及安全性的前瞻性单臂研究
时间:2025-02-16 12:09:10 热度:37.1℃ 作者:网络
[摘要] 背景与目的:洛铂作为一种传统的化疗药物,临床上应用广泛,近年来洛铂在腹腔热化疗领域的研究逐渐受到关注。本研究评价洛铂腹腔热灌注化疗在晚期腹腔转移癌中的疗效及安全性。方法:本研究收集2019年1月—2023年1月在上海市第十人民医院癌症中心就诊的晚期肿瘤伴恶性腹水的患者。对于不符合纳入标准的患者予以排除。本研究对纳入的患者的腹水量变化进行分析,评价腹腔热灌注治疗晚期腹腔转移癌的短期疗效。通过Kaplan-Meier法分析腹腔转移癌患者的长期生存。利用Pearson相关性分析评估治疗前后肿瘤标志物糖类抗原(carbohydrate 12-5,CA12-5)水平的相关性。患者的基线特征和治疗效果通过描述性统计呈现,同时采用显著性检验(P<0.01)比较治疗前后肿瘤标志物的变化。数据录入与统计分析使用SPSS 26.0完成,图形化展示使用GraphPad Prism 10.4.0绘制生存曲线和疗效图表。本研究项目已获得上海市第十人民医院伦理委员会批准(伦理批准号:SHSY-IEC-5.0/24K134/P01)。本前瞻性单臂研究严格遵守临床试验报告的统一标准(Consolidated Standards of Reporting Trials,CONSORT)。结果:本研究共纳入21例符合入组标准的患者。患者的中位年龄为61岁(范围31~71岁)。21例患者中,5例(23.8%)实现完全缓解,5例(23.8%)实现部分缓解,8例(38.1%)病情稳定,3例(14.3%)病情进展。总体有效率为47.6%,疾病控制率为85.7%。生存分析显示,患者中位无进展生存期为12.33个月,中位总生存期为16.37个月。治疗前后的肿瘤标志物分析显示疗效与CA12-5的水平呈负相关(P<0.01)。不良反应主要包括骨髓抑制、肝肾功能损伤及恶心呕吐。大多数不良反应为轻到中度。结论:洛铂腹腔热灌注治疗晚期胃肠道肿瘤恶性腹水患者疗效肯定,患者生存获益,安全性良好。CA12-5可能是预后不良的良好预测因素。
[关键词] 腹腔热灌注;化疗;恶性腹水;洛铂;前瞻性研究
[Abstract] Background and purpose: Lobaplatin, as a traditional chemotherapeutic drug, is widely used in the treatment of malignant tumor. In recent years, its application in the field of hyperthermic intraperitoneal chemotherapy (HIPEC) has garnered increasing attention. This study evaluated the efficacy and safety of lobaplatin-based HIPEC in advanced abdominal metastatic cancer. Methods: This study collected data of patients with advanced cancers and malignant ascites who treated in the Cancer Center of Shanghai Tenth People's Hospital, Tongji University School of Medicine, from January 2019 to January 2023. We excluded patients who did not meet the inclusion criteria. Short-term efficacy was assessed by changes in ascitic fluid volume, and long-term survival was analyzed using the Kaplan-Meier method. The correlation between CA12-5 levels before and after treatment was evaluated using Pearson correlation analysis. Baseline characteristics and treatment outcomes were described using descriptive statistics, and the changes in CA12-5 levels before and after treatment were compared using significance tests (P<0.01). Data entry and statistical analyses were conducted using SPSS version 26.0, and survival curves and efficacy plots were generated with GraphPad Prism (10.4.0 version). The study was approved by the Ethics Committee of Shanghai Tenth People's Hospital (Ethics approval number: SHSY-IEC-5.0/24K134/P01). This prospective single-arm study strictly adhered to the guideline of Consolidated Standards of Reporting Trials (CONSORT) checklist. Results: A total of 21 patients were enrolled in this study. The median age of the patients was 61 years (ranging from 31 to 71 years). Among the 21 patients, 5 (23.8%) achieved complete remission (CR), 5 (23.8%) achieved partial remission (PR), 8 (38.1%) had stable disease (SD), and 3 (14.3%) experienced disease progression (PD). The overall response rate (ORR) was 47.6%, and the disease control rate (DCR) was 85.7%. Survival analysis revealed a median progression-free survival (PFS) of 12.33 months and a median overall survival (OS) of 16.37 months. Analysis of tumor markers showed a significant negative correlation between efficacy and CA12-5 levels (P<0.01). Adverse reactions primarily included myelosuppression, hepatic and renal impairment, and nausea and vomiting, with most adverse events being mild to moderate. Conclusion: Lobaplatin-based HIPEC is effective in the treatment of advanced gastrointestinal malignancies with malignant ascites, providing survival benefits and demonstrating good safety. CA12-5 may serve as a valuable predictor of poor prognosis.
[Keywords] Hyperthermic intraperitoneal perfusion; Chemotherapy; Malignant ascites; Lobaplatin; Prospective study
腹腔转移是许多肿瘤性疾病常见的播散方式之一,患者的预后通常较差。尽管新的治疗方法正在被开发和应用,腹腔转移癌(peritoneal transfer carcinoma,PTC)患者的生存期仍然较短,中位生存期约为8个月,若伴有其他器官的转移,则预后更为严峻[1]。在结直肠癌患者中,有7%~15%的患者在手术前或手术中被确诊为腹腔转移,且在完成根治性手术后,仍有4%~19%的患者会发生腹腔转移。在所有转移性结直肠癌病例中,25%~30%是腹膜转移,与肝脏或肺部转移相比,腹腔转移癌的患者预后显得更差[2-4]。既往研究[5-8]表明,腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)在治疗PTC患者方面不良事件发生率较低,并且对有大量腹水的腹腔转移癌患者安全 有益。
与顺铂和卡铂相比,第三代烷化抗肿瘤药洛铂(lobaplatin)表现出良好的水溶性、广泛的抗癌谱和高抗肿瘤活性[9]。其抗肿瘤活性是由DNA药物加合物的形成引起的,主要是GG和AG链内交联。洛铂影响c-myc基因的表达,该基因参与肿瘤发生、细胞凋亡和细胞增殖[10]。在临床前模型研究中洛铂可以很好地抑制结直肠癌的增殖和腹膜转移[11]。然而,这种疗法的安全性及有效性,特别是洛铂HIPEC用于治疗腹腔转移癌时,有待进一步研究。在这里,我们评估了洛铂HIPEC在晚期腹腔转移癌中的安全性和有效性。
1 资料和方法
1.1 临床资料
本研究收集2019年1月—2023年1月在上海市第十人民医院癌症中心就诊的晚期肿瘤伴恶性腹水的患者。本研究的纳入标准为:① 组织病理学诊断为腹腔转移癌;② 腹水、超声或CT检测到肿瘤;③ 腹膜转移癌化疗失败;④ 18岁 ≤年龄≤85岁;⑤ 卡诺夫斯基量表(Karnofsky performance scale,KPS)评分≥50分;⑥ 无临床上未经控制的活动性感染;⑦ 无明显骨髓抑制及肝肾功能损害和凝血功能异常者;⑧ 无化疗药物过敏史;⑨ 无严重心、肝、肾功能不全或其他重要脏器功能受损者;⑩ 无哺乳或妊娠期的妇女。排除标准:① KPS<50分;② 存在未控制的活动性感染;③ 合并其他严重伴随疾病:合并严重的心脏病(如心功能Ⅲ或Ⅳ级)/肾功能不全(如eGFR<30 mL/min,每1.73㎡)/肝功能不全(如Child-Pugh评分C级);④ 近期接受其他临床试验的药物治疗;⑤化疗禁忌证包括对化疗药物已知严重的过敏反应;⑥ 腹腔或腹膜以外的广泛转移。本研究经同济大学附属第十人民医院机构审查委员会(IRB)批准后进行(伦理批准号:SHSY-IEC-5.0/24K134/P01),符合《赫尔辛基宣言》。所有患者均已在本中心获得知情同意。
1.2 治疗方案
HIPEC是采用珠海和佳医疗设备有限公司的体腔热灌注治疗机闭合式灌注,治疗药物为洛铂(50 mg/m2),加入1 000~1 500 mL生理盐水中,将灌流液加热后以100~150 mL/min的流速循环,维持腹内温度43 ℃共30 min。灌注过程中所有患者均采取持续静脉补液、监测生命体征和尿量。同时所有入组患者在进行HIPEC治疗后均进行了后续的全身抗肿瘤治疗。患者采用标准的晚期肿瘤复发转移的系统化疗方案。
1.3 评效方法
基线评估涵盖了患者的病史、全面体格检查、血清肿瘤标志物[如糖类抗原(carbohydrate 12-5,CA12-5)]及肝肾功能等血液指标的测定,以及在治疗前一周进行的腹部B超检查。为了评估治疗效果,每隔4周将对患者进行一次疗效评估。B超检查的具体操作是在患者仰卧位下,通过在左下腹或右下腹区域进行超声平扫,直接测量游离无回声区域。疗效的评估遵循体腔积液肿瘤热疗的疗效评价指南[12],评价标准包括:完全缓解(complete response,CR)定义为腹水完全消失,持续时间至少4周;部分缓解(partial response, PR)定义为腹水量减少≥50%,持续时间至少4周;疾病稳定(stable disease,SD)定义为腹水量的变化+25%至-50%,持续时间至少4周;疾病进展(progressive disease,PD)定义为腹水增加≥25%,或出现新的病灶[6]。客观缓解率(objective response rate,ORR)计算为(CR+PR)/总例数×100%。疾病控制率(disease control rate,DCR)计算为(CR+PR+SD)/总例数×100%。无进展生存期(progression-free survival,PFS)为患者从开始接受HIPEC治疗到疾病进展或死亡所经历的时间。总生存期(overall survival,OS)为患者从开始接受HIPEC治疗到死亡的时间。此外,还将记录治疗期间患者出现的所有不良反应情况。
1.4 统计学处理
本研究采用Kaplan-Meier法分析患者的PFS和OS,并通过log-rank检验进行单因素分析。对PFS、OS与治疗方案及肿瘤标志物CA12-5水平进行相关性分析,在分析前先进行数据分布的正态性检验:如符合正态分布,则进一步进行Pearson相关系数分析;如不符合正态分布,则采用Spearman相关性检验。患者的基线特征和治疗效果通过描述性统计呈现,同时采用显著性检验(P<0.01)比较治疗前后肿瘤标志物的变化。P<0.05为差异有统计学意义。数据录入与统计分析使用SPSS 26.0完成,图形化展示使用GraphPad Prism 10.4.0绘制生存曲线和疗效图表。
2 结 果
2.1 洛铂HIPEC治疗的疗效评估
共有133例患者参与了初步研究。其中,73例患者未接受HIPEC化疗。在剩余的60例患者中,有39例患者因使用了其他治疗方案而被排除在外,最后剩下21例患者进行分析,详见纳入和排除流程图(图1)。
本研究共纳入了21例接受洛铂HIPEC的患者,其中男性7例(33.3%),14例(66.7%),中位年龄为61岁(范围31~71岁)。具体的人口统计学和临床数据见表1。经过治疗,5例患者(23.8%)实现了CR,5例患者(23.8%)实现了PR,8例患者(38.1%)为SD,而3例患者(14.3%%)出现了PD。ORR为47.6%,DCR达85.7%。对患者的生存获益分析之后,我们观察到接受洛铂HIPEC治疗的患者中位PFS为12.33个月,中位OS为16.37个月(表2、图2~4)。
本研究中PFS、OS与方案之间存在线性关系,且没有明显异常值,两组变量均服从近似正态分布(P>0.05),可以采用Pearson相关性分析。经Pearson相关性分析发现,PFS、OS与方案之间呈中度正相关(r=-0.529,P=0.014;r=-0.511,P=0.018)。总体而言,洛铂HIPEC在治疗晚期恶性腹水方面显示了积极的短期疗效。
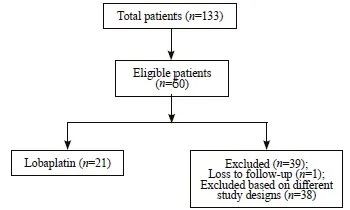
图1 患者纳入和排除流程图
Fig. 1 Patient inclusion and exclusion flowchart
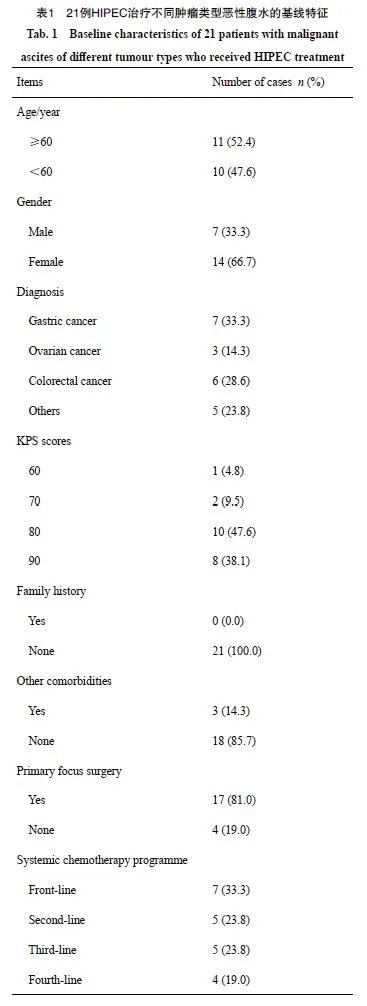

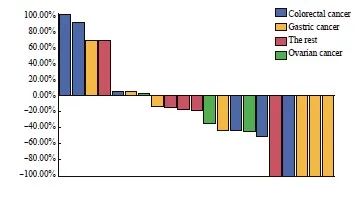
图2 21例晚期恶性腹水患者接受洛铂HIPEC疗效图
Fig. 2 Efficacy of lobaplatin HIPEC in 21 patients with advanced malignant ascites
图3 21例晚期恶性腹水患者接受洛铂HIPEC的PFS
Fig. 3 PFS of 21 patients with advanced malignant ascites treated with lobaplatin HIPEC
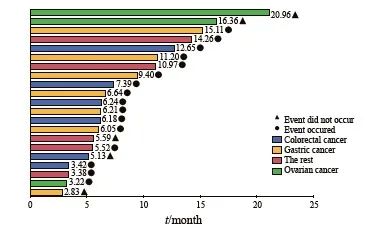
图4 21例晚期恶性腹水患者接受洛铂HIPEC的OS
Fig. 4 OS of 21 patients with advanced malignant ascites treated with lobaplatin HIPEC
2.2 洛铂HIPEC治疗前后肿瘤标志物的变化
使用GraphPad Prism 10.4.0软件对患者在治疗前后的肿瘤标志物CA12-5进行了分析,结果显示治疗前后肿瘤标志物水平差异有统计学意义。具体数据请参考图5。对数据进行皮尔逊相关性分析,我们发现热灌注次数与CA12-5水平变化呈中等程度负相关(r=-0.489),并且这一相关性差异有统计学意义(P<0.024)。
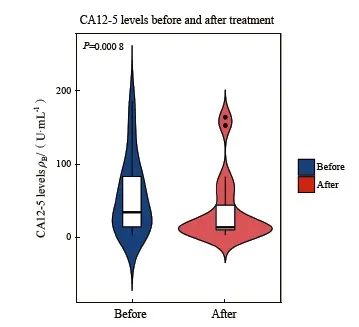
图5 21例晚期恶性腹水患者接受洛铂HIPEC后肿瘤标志物变化
Fig. 5 Changes in tumor markers in 21 patients with advanced malignant ascites after treatment with lobaplatin HIPEC
2.3 洛铂HIPEC治疗的不良反应
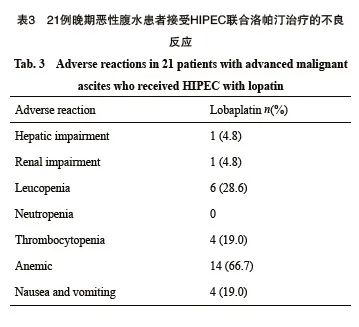
在本研究中,不良事件(adverse event, AE)是HIPEC治疗过程中需要特别关注的。HIPEC治疗中可能出现的不良反应包括多汗、心率加快、发热和消化道反应。所有患者在HIPEC治疗过程中均未出现不良反应。但观察到患者HIPEC术后有不良反应,主要包括骨髓抑制、肝肾功能损伤及恶心呕吐等。具体而言,出现肝功能损伤的患者为1例(占4.8%),肾功能损伤也为1例(占4.8%),均属于1级AE。白细胞减少共有6例(28.6%)患者,其中5例为1级AE,1例为2级AE。未发现中性粒细胞减少的病例。血小板减少患者共4例(19.0%),3例归类为1级AE,1例为2级AE。贫血患者共14例(66.7%),6例为1级AE,7例为2级AE,1例为3级AE。仅4例(19.0%)患者出现轻度恶心呕吐症状。这些不良反应多数为轻到中度(1~2级),仅极少数病例达到3级的严重程度。值得一提的是,本研究中未观察到任何极其严重的4级不良反应(表3)。
3 讨 论
腹部或系统性恶性肿瘤容易诱发腹内脏壁弥漫性病变,进一步导致腹膜腔内液体的病理性积聚,临床上称为恶性腹水。患者生存质量很差,常伴随腹痛、食欲不振、呼吸困难、便秘、尿频、厌食和呕吐等症状[13]。恶性腹水患者约占所有腹水患者的10%,但多达50%的晚期癌症患者可能发生恶性腹水。恶性腹水患者的预后很差,患者生存期短,5年OS率低于35%[14]。治疗恶性腹水的主要目的是提高患者的生活质量,减轻患者的痛苦,从而延长患者的生存期。
HIPEC是辅助治疗腹部恶性肿瘤的有效方法,相比传统化疗药物,在治疗腹膜种植恶性肿瘤方面具有极其明显的临床优势。HIPEC能够使化疗药物充分接触腹腔内的小转移灶,机械性地清除游离的腹部癌细胞,并在腹腔内维持一个恒定、高浓度的药物环境,同时减少进入体循环的药物量,从而降低全身不良反应的发生率。有研究[15]表明,HIPEC可以有效地杀死肿瘤细胞,破坏病灶区域的血管结构,减少对肿瘤组织的血液供应,并能有效地抑制肿瘤增殖。此外,HIPEC还可以有效地增强细胞膜通透性,抑制肿瘤细胞自我修复,增加药物病灶的通透性,提高疗效[16]。研究[17]发现,如果热疗的温度低于41 ℃,则治疗效果不佳,但当温度高于45 ℃时,正常的组织器官也会受到损害。大多数肿瘤细胞的临界死亡温度为43 ℃,因此,将治疗温度控制在43~45 ℃,可以有效地杀灭肿瘤细胞。
研究[18]表明,洛铂能有效地抑制胃肠道肿瘤细胞的生长,引发细胞凋亡,增加活性氧的生成,显著降低线粒体膜电位,并通过上调促凋亡蛋白Bax和caspase-3,有效地阻断肿瘤细胞的迁移和侵袭。另有研究[19]发现,洛铂通过caspase-3切割GSDME/DFNA5诱导细胞的热凋亡。此外,有研究[20]表明,热疗可以增强洛铂等药物对胰腺癌的治疗效果。洛铂作为一种第三代铂类抗肿瘤药物,由德国ASAT公司(AstaMedica AG, Frankfurt)研发,展现了显著的抗肿瘤效果,并且具备较低的不良反应风险。相比其他铂类药物,洛铂的一个显著优势是其没有交叉耐药性。有国内专家共识也推荐其腹腔给药[21]。
在顺铂HIPEC治疗胃癌恶性腹水的研究[22]中,患者的中位OS为8.6个月,1年OS率为24.4%。而在郭培明等[23]的研究中,对比了常规腹腔化疗与HIPEC的临床疗效,观察组患者短期总有效率为91.11%,而对照组则为40%。本文分析了21例洛铂HIPEC治疗晚期恶性腹水患者的结果,也与前述结果类似。其中,CR 5例,PR 5例,SD 8例,PD 3例;ORR为47.6%,DCR为85.7%。这表明洛铂HIPEC能够有效地控制病情,为患者带来生存获益。此外,中位PFS为12.33个月,中位OS为16.37个月,1年OS率为23.8%。总体来看,本研究证实了洛铂HIPEC治疗晚期胃肠道肿瘤恶性腹水的良好短期效果,进一步呈现了洛铂HIPEC在延长患者生存期方面的潜力。
同时,在安全性方面,我们在洛铂HIPEC过程中未观察到不良反应。铂类药物的不良反应主要涵盖消化道反应、骨髓毒性、肝肾毒性、耳毒性、神经毒性等方面[24]。本研究在患者治疗之后观察到的不良反应主要包括骨髓抑制、肝肾功能损伤及恶心呕吐等,大多数为轻到中度,极少数达到严重程度,未观察到极度严重的不良反应。这表明洛铂HIPEC的安全性良好,可以在临床推广应用。
另外,我们还观察到肿瘤标志物CA12-5与恶性腹水患者预后相关。CA12-5是一种糖蛋白类抗原,也称为MUC16,通常在上皮性卵巢肿瘤患者的血清中升高,但也可能在其他非卵巢恶性肿瘤中升高,如胸膜、腹膜和心包内壁的细胞。它能促进上皮-间质转化,这也是卵巢癌转移的基本过程[25],而且血清CA12-5水平升高与卵巢癌的复发风险和患者生存率密切相关[26]。本研究发现热灌注次数与CA12-5水平变化之间呈中度的负相关(r=-0.489),并且这一相关性差异有统计学意义(P<0.024)。这一结果提示, CA12-5水平的显著下降与治疗反应良好相关。有研究[27]表明,在T4期胃癌术后患者中进行预防性HIPEC时,洛铂能够显著地降低局部复发率和血液肿瘤标志物水平,并显著提高HIPEC组的5年无病生存率。在一项5-FU加丝裂霉素或卡铂治疗恶性腹水的研究[28]中发现,治疗后患者血清CA12-5和CA19-9水平显著降低(P均<0.01)。因此,CA12-5可能成为评估恶性腹水患者治疗效果和预后的重要指标。
在最新的研究[29-30]中,靶向治疗和免疫治疗在胃癌、结直肠癌、卵巢癌等腹腔转移癌的治疗领域展现出显著的潜力。特别是程序性死亡受体1(programmed death-1,PD-1)/程序性死亡受体配体1(programmed death-ligand 1,PD-L1)抑制剂,如帕博利珠单抗(keytruda)和纳武利尤单抗(opdivo),在某些晚期胃癌患者的治疗中取得了积极疗效,尤其是在微卫星高度不稳定(microsatellite instability-high,MSI-H)或错配修复缺陷(mismatch repair deficiency,dMMR)的患者群体中。此外,初步临床研究[31]显示,卡妥索单抗(catelumab)作为一种免疫检查点抑制剂,对腹膜转移癌患者具有治疗潜力[31]。在结直肠癌的治疗中,抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物,例如贝伐珠单抗已被证实能够为晚期患者带来生存益处[32]。同样,针对多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]的药物,如奥拉帕尼(olaparib),在携带BRCA突变的卵巢癌患者中也显示出了显著的生存改善[33]。本研究进一步观察到,腹腔转移癌患者的PFS及OS与所采取的治疗方案呈明显的负相关。这一结果突显了在治疗策略上采取个性化方法的重要性,意味着治疗方案需要综合考虑局部病灶的治疗以及全身系统性治疗的协同效应。强调了在制订治疗方案时必须兼顾局部控制和系统性干预,以期实现最佳的治疗效果和对患者生存率的提高。
本究存在局限性。这是一项单中心的单臂前瞻性研究,因此在研究设计和数据收集方面存在一定的局限性。尽管洛铂在HIPEC中的疗效得到了确认,但其作用机制尚未得到进一步阐明。在未来的临床试验中,需要考虑扩大样本量,并对恶性腹水患者进行更全面的数据收集。尽管我们观察到了令人鼓舞的临床益处和安全性,但我们仍需进一步探索HIPEC是否能够为恶性腹水患者带来长期获益,以及探索洛铂的疗效和毒性是否存在剂量依赖性。综上所述,洛铂HIPEC治疗晚期胃肠道肿瘤恶性腹水患者的效果值得肯定,安全性良好。
利益冲突声明:所有作者均声明无利益冲突。
作者贡献声明:柯追负责撰写论文;高洁负责数据分析;卢静怡、罗欣佩负责数据收集,贺学敏负责数据整理;刘竹青负责文献分析,袁敏、郭献灵负责论文修改;许青负责技术支持、资金支持。
[参考文献]
[1] LEMMENS V E, KLAVER Y L, VERWAAL V J, et al. Predictors and survival of synchronous peritoneal carcinomatosis of colorectal origin: a population-based study[J]. Int J Cancer, 2011, 128(11): 2717-2725.
[2] CEELEN W P, FLESSNER M F. Intraperitoneal therapy for peritoneal tumors: biophysics and clinical evidence[J]. Nat Rev Clin Oncol, 2010, 7(2): 108-115.
[3] KOPPE M J, BOERMAN O C, OYEN W J, et al. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies[J]. Ann Surg, 2006, 243(2): 212-222.
[4] MURONO K, KAWAI K, HATA K, et al. Regimens of intraperitoneal chemotherapy for peritoneal carcinomatosis from colorectal cancer[J]. Anticancer Res, 2018, 38(1): 15-22.
[5] BA M C, CUI S Z, LONG H, et al. Safety and effectiveness of high-precision hyperthermic intraperitoneal perfusion chemotherapy in peritoneal carcinomatosis: a real-world study[J]. Front Oncol, 2021, 11: 674915.
[6] MAGGE D, RAMALINGAM L, SHUAI Y L, et al. Hyperthermic intraperitoneal chemoperfusion as a component of multimodality therapy for ovarian and primary peritoneal cancer[J]. J Surg Oncol, 2017, 116(3): 320-328.
[7] YANG X J, HUANG C Q, SUO T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase Ⅲ randomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6): 1575-1581.
[8] WONG J S M, TAN G H C, CHIA C S, et al. The importance of synchronicity in the management of colorectal peritoneal metastases with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. World J Surg Oncol, 2020, 18(1): 10.
[9] ZHONG Y X, ZHANG J, BAI X F, et al. Lobaplatin in prophylactic hyperthermic intraperitoneal chemotherapy for advanced gastric cancer: safety and efficacy profiles[J]. Cancer Manag Res, 2020, 12: 5141-5146.
[10] MCKEAGE M J. Lobaplatin: a new antitumour platinum drug[J]. Expert Opin Investig Drugs, 2001, 10(1): 119-128.
[11] SHAN L N, BAI B J, LV Y M, et al. Lobaplatin suppresses proliferation and peritoneal metastasis of colorectal cancer in a preclinical model[J]. Biomedecine Pharmacother, 2018, 108: 486-491.
[12] 中日医学科技交流协会热疗专业委员会, 中华医学会放疗分会热疗专业委员会. 中国肿瘤热疗临床应用指南(2017.V1.1)[J]. 中华放射肿瘤学杂志, 2017, 26(4): 369-375.
Sino Japan Science and Technology Association, Chinese Medical Association Radiotherapy Branch Thermotherapy Specialized Committee. Chinese application guide of clinical application of tumor hyperthermia (2017.V1.1)[J]. Chin J Radiat Oncol, 2017, 26(4): 369-375.
[13] JEFFRIES J, GAYED M, HA T G V, et al. Management of malignant pleural effusions and malignancy-related ascites[J]. Semin Intervent Radiol, 2020, 37(4): 434-440.
[14] MAEDA H, KOBAYASHI M, SAKAMOTO J. Evaluation and treatment of malignant ascites secondary to gastric cancer[J]. World J Gastroenterol, 2015, 21(39): 10936-10947.
[15] DEGETT T H, POMMERGAARD H C, GÖGENUR I. Hyperthermic intraperitoneal chemotherapy at the primary gastrointestinal cancer operation[J]. Ugeskr Laeger, 2017, 179(12): V06160454.
[16] RAJEEV R, TURAGA K K. Hyperthermic intraperitoneal chemotherapy and cytoreductive surgery in the management of peritoneal carcinomatosis[J]. Cancer Control, 2016, 23(1): 36-46.
[17] RIHUETE CARO C, MANZANEDO I, PEREIRA F, et al. Cytoreductive surgery combined with hyperthermic intraperitoneal chemotherapy (HIPEC) in patients with gastric cancer and peritoneal carcinomatosis[J]. Eur J Surg Oncol, 2018, 44(11): 1805-1810.
[18] LI Y L, LIU B, YANG F F, et al. Lobaplatin induces BGC-823 human gastric carcinoma cell apoptosis via ROS- mitochondrial apoptotic pathway and impairs cell migration and invasion[J]. Biomedecine Pharmacother, 2016, 83: 1239-1246.
[19] YU J H, LI S, QI J, et al. Cleavage of GSDME by caspase-3 determines lobaplatin-induced pyroptosis in colon cancer cells[J]. Cell Death Dis, 2019, 10(3): 193.
[20] MAURICI C E, COLENBIER R, WYLLEMAN B, et al. Hyperthermia enhances efficacy of chemotherapeutic agents in pancreatic cancer cell lines[J]. Biomolecules, 2022, 12(5): 651.
[21] 中国医师协会结直肠肿瘤专业委员会腹膜肿瘤专委会. 结直肠癌腹膜转移诊治中国专家共识(2022版)[J]. 中华结直肠疾病电子杂志, 2022, 11(4): 265-271.
Professional Committee of Peritoneal Metastasis. Chinese expert consensus on the diagnosis and treatment of colorectal cancer peritoneal metastases (2022 edition)[J]. Chin J Colorectal Dis Electron Ed, 2022, 11(4): 265-271.
[22] NI X F, WU P, WU J, et al. Hyperthermic intraperitoneal perfusion chemotherapy and response evaluation in patients with gastric cancer and malignant ascites[J]. Oncol Lett, 2017, 14(2): 1691-1696.
[23] JIAO J, LI C Z, YU G Y, et al. Efficacy of hyperthermic intraperitoneal chemotherapy (HIPEC) in the management of malignant ascites[J]. World J Surg Oncol, 2020, 18(1): 180.
[24] 广东省药学会. 铂类药物临床应用与不良反应管理专家共识[J]. 今日药学, 2019, 29(9): 577-586.
Guangdong Pharmaceutical Association. Expert consensus on clinical application of platinum drugs and adverse reaction management[J]. Pharm Today, 2019, 29(9): 577-586.
[25] WINARNO G N A, HIDAYAT Y M, SOETOPO S, et al. The role of CA12-5, GLS and FASN in predicting cytoreduction for epithelial ovarian cancers[J]. BMC Res Notes, 2020, 13(1): 346.
[26] PIATEK S, PANEK G, LEWANDOWSKI Z, et al. Rising serum CA12-5 levels within the normal range is strongly associated recurrence risk and survival of ovarian cancer[J]. J Ovarian Res, 2020, 13(1): 102.
[27] ZHONG Y X, KANG W Z, HU H T, et al. Lobaplatin-based prophylactic hyperthermic intraperitoneal chemotherapy for T4 gastric cancer patients: a retrospective clinical study[J]. Front Oncol, 2023, 13: 995618.
[28] WU Y B, PAN M X, CUI S Z, et al. Efficacy and safety of ultrasound-guided continuous hyperthermic intraperitoneal perfusion chemotherapy for the treatment of malignant ascites: a midterm study of 36 patients[J]. Onco Targets Ther, 2016, 9: 403-407.
[29] SHITARA K, VAN CUTSEM E, BANG Y J, et al. Efficacy and safety of pembrolizumab or pembrolizumab plus chemotherapy vs chemotherapy alone for patients with first-line, advanced gastric cancer: The KEYNOTE-062 phase 3 randomized clinical trial[J]. JAMA Oncol, 2020, 6(10): 1571-1580.
[30] DERKS S, VAN LAARHOVEN H W M. Can we do without chemotherapy? A perspective on the combinations nivolumabchemotherapy and nivolumab-ipilimumab in metastatic gastric and esophageal cancer[J]. Ther Adv Med Oncol, 2022, 14: 17588359221142788.
[31] K NÖD L E R M , KÖR F E R J , K U N Z M A N N V , e t a l . Randomised phase Ⅱ trial to investigate catumaxomab (anti-EpCAM × anti-CD3) for treatment of peritoneal carcinomatosis in patients with gastric cancer[J]. Br J Cancer, 2018, 119(3): 296-302.
[32] WANG F, HE M M, XIAO J, et al. A randomized, openlabel, multicenter, phase 3 study of high-dose vitamin C plus FOLFOX ± bevacizumab versus FOLFOX ± bevacizumab in unresectable untreated metastatic colorectal cancer (VITALITY study)[J]. Clin Cancer Res, 2022, 28(19): 4232-4239.
[33] Olaparib makes OS gains in ovarian cancer[J]. Cancer Discov, 2020, 10(7): OF3.


