读书报告 | 通过阻止肿瘤微环境中癌症干细胞和免疫细胞的联系来改善癌症免疫治疗
时间:2024-12-09 06:01:48 热度:37.1℃ 作者:网络
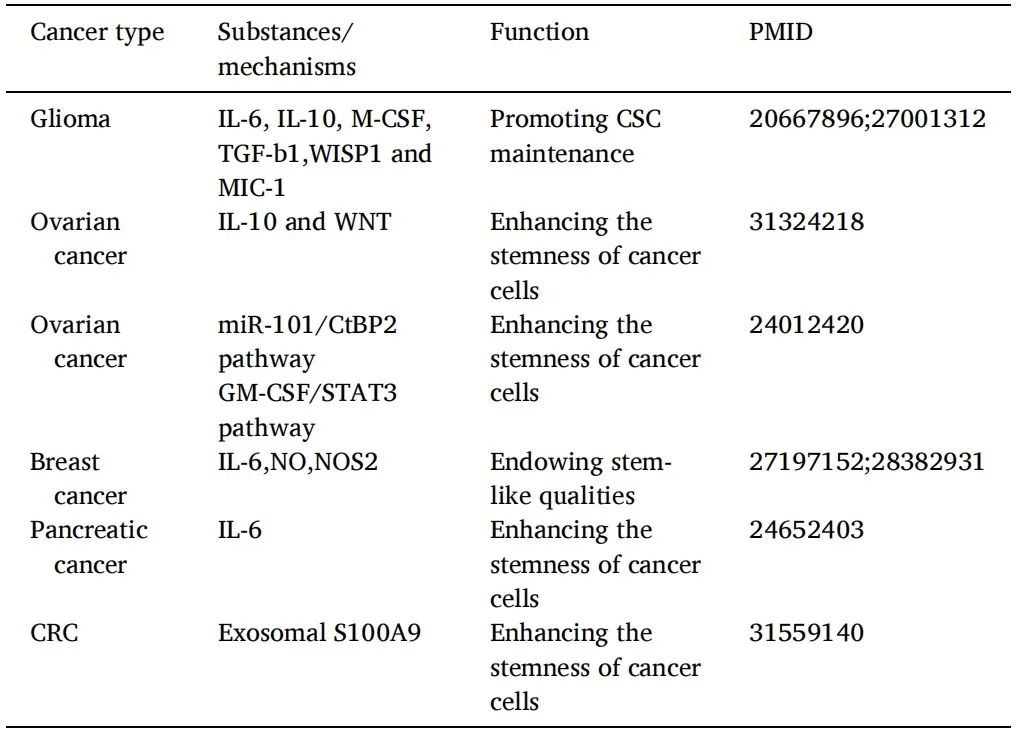
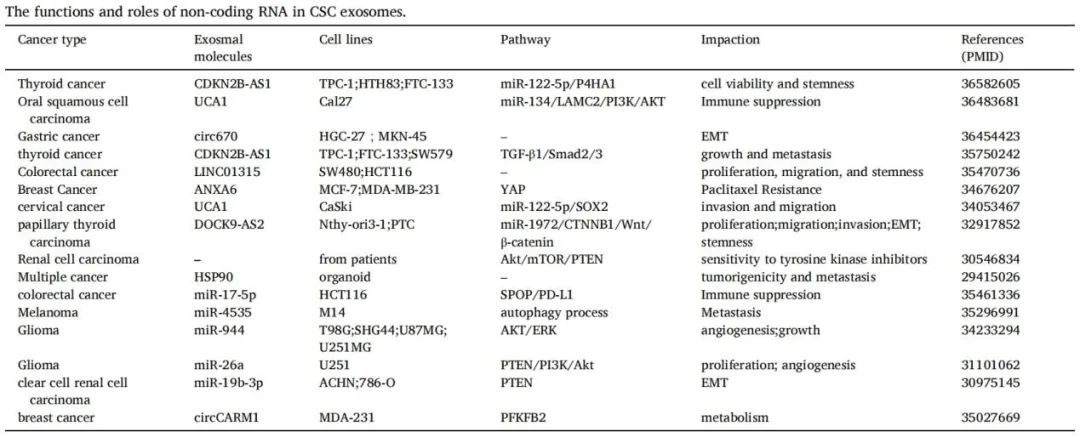
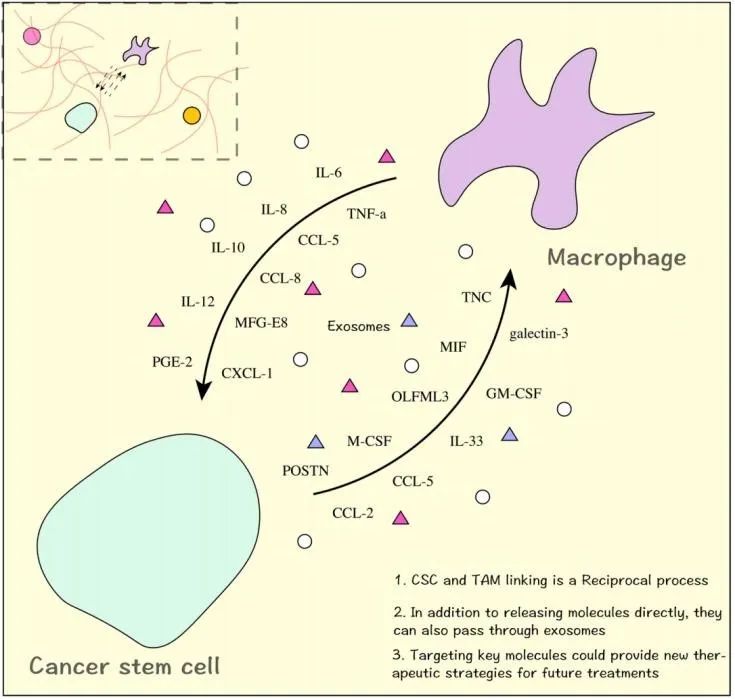
导读 在癌症治疗的众多策略中,免疫疗法因其能够激活患者自身免疫系统对抗肿瘤的潜力而备受关注。然而,癌症干细胞(CSCs)的存在使得这一治疗策略面临重大挑战。CSCs不仅在肿瘤的复发和转移中起着关键作用,而且它们还能够通过与免疫细胞的相互作用来逃避免疫监视,导致传统免疫疗法效果受限。 本文概述了CSCs的特性,包括它们的自我更新能力和多向分化潜力,以及它们在肿瘤进展中的关键作用。文章重点讨论了CSCs如何通过分泌外泌体与免疫细胞进行交流,从而调节肿瘤微环境中的免疫反应。这些外泌体携带的分子能够影响免疫细胞的功能,包括树突状细胞的成熟、肿瘤相关巨噬细胞的极化以及T细胞的激活。此外,文章还探讨了CSCs外泌体在免疫抑制分子表达中的作用,以及它们如何参与形成前转移生态位和增强化疗抗性。这些发现揭示了CSCs在肿瘤免疫逃逸中的复杂机制,并为开发新的治疗靶点提供了理论基础。 本文的最终目的是为癌症治疗提供新的视角和策略。通过深入了解CSCs与免疫细胞之间的相互作用,可以设计出更有效的治疗手段来阻断这些交流,从而增强免疫系统对肿瘤的攻击能力。文章提出的针对CSCs外泌体的靶向治疗策略,为改善癌症免疫疗法提供了新的方向。这些策略可能包括阻断CSCs外泌体的释放、干预其与免疫细胞的相互作用,以及开发能够模拟这些外泌体的纳米粒子用于药物递递(BiomedPharmacothe. 2024Jan:170:116043. doi: 10.1016 /j.biopha.2023.116043)。 文献的主要观点: 1. CSCs衍生分子调节肿瘤免疫微环境。Table1为我们提供了一个全面的视角,展示了不同类型的癌症中,CSCs如何通过特定的分子来招募和调节免疫细胞,从而促进肿瘤的进展和免疫逃逸。例如,在胶质瘤中,CSCs通过释放OLFML3、POSTN、CXCL12B、CCL5和CX3CL1等分子,能够招募免疫抑制性小胶质细胞、M2型肿瘤相关巨噬细胞,并招募T细胞。这些分子的释放不仅促进了肿瘤的免疫逃逸,还增强了肿瘤的侵袭性。在膀胱癌中,CSCs通过IL-6和CCL2的释放,促进了M2型巨噬细胞的极化。这种极化过程对于肿瘤微环境中的免疫抑制状态至关重要。在肝癌中,CSCs释放的CCL2和M-CSF分子,同样参与了M2型肿瘤相关巨噬细胞的招募。这些巨噬细胞在肿瘤微环境中起到了促进肿瘤生长和免疫逃逸的作用。在黑色素瘤中,TGF-β的释放促进了M2型MDSCs的招募,进一步增强了肿瘤的免疫抑制能力。而在胶质母细胞瘤(GBM)中,CSCs释放的外泌体能够抑制T细胞的激活和增殖,并通过下调HLA-DR来抑制免疫反应。在前列腺癌中,TNC的释放阻止了T细胞的激活。在乳腺癌中,CCL1的释放则招募了调节性T细胞(Tregs),这些Tregs在肿瘤免疫逃逸中扮演了关键角色。 2.CSCs与其微环境中的免疫细胞之间的相互作用是双向的。 免疫细胞不仅受到CSCs的影响,而且它们还能通过分泌特定的分子来调节CSCs的特性,包括维持其干性、促进肿瘤生长和转移。在Table 2中,研究者列出了不同癌症类型中免疫细胞如何通过特定分子影响CSCs的干性。例如在胶质瘤中,IL-6、IL-10、M-CSF、TGF-β1、WISP1和MIC-1等分子被证实能够促进CSCs的维持。这些分子通过多种信号通路,如JAK/STAT、NF-κB和Wnt/β-catenin,增强CSCs的自我更新能力和肿瘤形成潜力。在卵巢癌中,IL-10和WNT信号通路被发现能够增强癌细胞的干性。此外,miR-101/CtBP2和GM-CSF/STAT3信号通路也在卵巢癌CSCs的干性调节中发挥作用。这些发现揭示了免疫细胞如何通过精细调控的分子网络来影响CSCs的特性。在乳腺癌中,IL-6和NO通过激活STAT3信号通路,赋予癌细胞干细胞样特性。而在胰腺癌中,IL-6同样增强了癌细胞的干性。这些结果表明,免疫细胞分泌的细胞因子在不同癌症中可能通过相似的机制来调节CSCs。在结直肠癌(CRC)中,外泌体S100A9被发现能够增强癌细胞的干性。 3.CSCs的外泌体作为细胞间通讯和肿瘤微环境的调控的纽带,其中包含的非编码RNA,包括miRNA和lncRNA,在调控基因表达和细胞功能中扮演着关键角色。 在Table3中,研究者列出了多种癌症类型中外泌体中的特定非编码RNA分子,以及它们对细胞功能的影响。例如,在甲状腺癌中,外泌体中的CDKN2B-AS1通过miR-122-5p/P4HA1轴影响细胞活力和干性。在口腔鳞状细胞癌中,UCA1通过miR-134/LAMC2/PI3K/AKT信号通路抑制免疫反应。在胃癌中,circ670作为一种外泌体分子,通过影响EMT(上皮-间质转化)过程,促进肿瘤的侵袭和转移。而在结直肠癌中,LINC01315通过调节增殖、迁移和干性,增强了肿瘤细胞的恶性行为。特别值得注意的是,在乳腺癌中,ANXA6通过YAP信号通路与紫杉醇耐药性相关。这些发现揭示了非编码RNA在CSCs外泌体中的作用,不仅在肿瘤发展中起着关键作用,而且在化疗耐药性中也扮演着重要角色。 4.巨噬细胞可能是一个调节节点。 由于巨噬细胞在肿瘤微环境中扮演着多重角色,它们的状态和功能同样也会受到CSCs的直接影响。Figure 1中,研究者向我们展示了CSCs与巨噬细胞之间复杂的相互作用网络。这些相互作用不仅涉及多种细胞因子和信号分子,还包括了CSCs释放的外泌体,它们携带着能够调节巨噬细胞功能的分子。研究者特别关注了CSCs释放的POSTN、M-CSF、MIF、TNC、OLFML3以及CCL家族成员等分子。这些分子能够促进巨噬细胞的招募,并诱导它们向M2型极化,这是一种与肿瘤促进和免疫抑制相关的巨噬细胞表型。M2型巨噬细胞能够释放IL-6、IL-8、IL-10和CCL5等分子,这些分子进一步调节CSCs的干性,形成了一个正反馈循环,促进了肿瘤的进展和免疫逃逸。此外,研究者还描述了CSCs与巨噬细胞之间的相互作用是如何在不同癌症类型中发挥作用的。例如在胶质瘤中,CSCs通过CXCL12/CXCR4信号通路与巨噬细胞相互作用,而在乳腺癌和胰腺癌中,MDSCs通过分泌IL-6激活STAT3信号通路,增强CSCs的干性。 5.其他调节因素。 除了影响巨噬细胞的生物学行为,CSCs在肿瘤微环境中还与多种免疫细胞相互作用,在Figure 2中,我们可以看到CSCs与这些免疫细胞之间复杂的相互作用网络。例如,CSCs通过释放TGF-β、TNC、CCL-2、OGT、Galectin-3和外泌体等分子,能够抑制T细胞的激活和增殖,从而削弱抗肿瘤免疫反应。另外,CSCs如何通过释放TGF-β、MIF、IL-8、GM-CSF、miR-92和外泌体等分子来调节MDSCs的招募。MDSCs是一群具有免疫抑制功能的骨髓源细胞,它们在肿瘤微环境中的积累与肿瘤的免疫逃逸和治疗抵抗性密切相关。CSCs还可以通过释放CCL-2、IL-8、CCL-5、G-CSF和TGF等分子来调节Tregs的功能。Tregs是一群调节性T细胞,它们通过抑制效应T细胞的活性来维持免疫耐受,而在肿瘤微环境中,它们的存在有助于肿瘤的免疫逃逸。 小结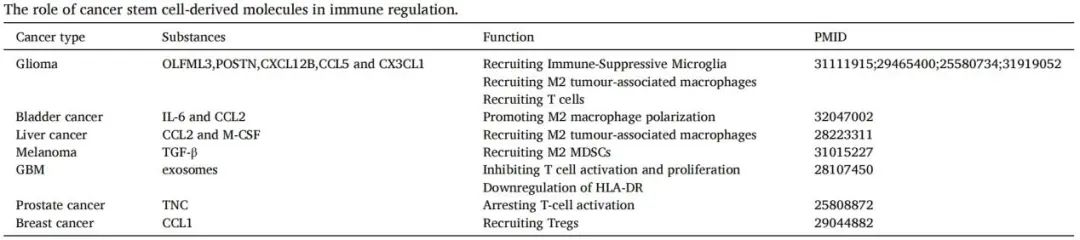
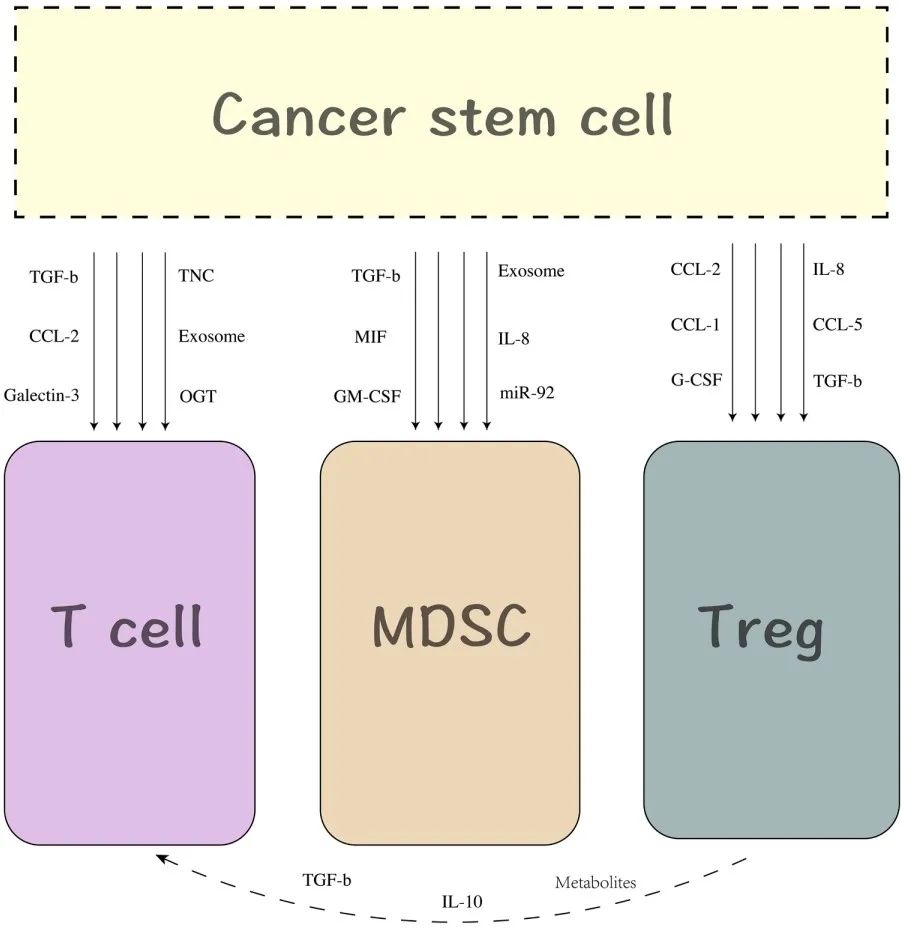
本文综合了CSCs与免疫细胞相互作用的多个方面,提供了一个全面的视角来理解肿瘤微环境中的复杂动态。
本文探讨了CSCs如何通过外泌体影响免疫细胞的功能和肿瘤微环境,为理解肿瘤免疫逃逸机制提供了新的见解。
本文强调了CSCs在癌症治疗中的重要性,并提出了针对CSCs的潜在治疗策略, 如针对CSCs外泌体的靶向治疗策略等。


