上海交通大学王琼团队《自然·通讯》: TGFβ-SMAD信号通路与DNA甲基化协同调控小鼠胚胎植入的发育机制
时间:2024-11-26 12:02:47 热度:37.1℃ 作者:网络
经典的TGFβ信号主要通过Smad2/3与辅助因子Smad4结合所形成的转录因子复合物进行传导【1】。然而,研究表明这些受体结合的Smad分子有时也可以替代或绕过Smad4来激活TGFβ下游的靶基因【2-4】,但其中的调控机制亟待研究。
2024年11月22日,上海交通大学医学院王琼研究团队等在Nature Communications上发表了题为A stepwise mode of TGFβ-SMAD signaling and DNA methylation regulates naïve-to-primed pluripotency and differentiation的研究【5】。该研究提出了一种胚胎干细胞在原始态-始发态-分化过程中的分步调控模型。

该研究以小鼠胚胎干细胞(mESCs)为模型,结合多组学数据和蛋白质谱的方法,确定了Smad2/3通过依赖与非依赖Smad4的方式调控干细胞命运的不同发展阶段,阐明了TGFβ-Smad信号通路与DNA甲基化等表观遗传修饰协同调控小鼠胚胎植入的发育机制。首先,Smad2/3-Dnmt3b决定了干细胞从低甲基化的原始态向高甲基化的始发态上胚层的转变。Smad2/3结合并上调Dnmt3b。一方面,Dnmt3b保证了从头DNA甲基化模式的建立,并通过甲基化Sox2等多能性因子来促进干细胞从原始态逐步退出。另一方面,Dnmt3b能直接与Smad2/3互作并促进Smad2/3结合到上胚层顺式作用元件中心的低甲基化谷,这一过程可能依赖于H3K36me2/3。随后,上胚层通过原肠运动分化为中内胚层谱系。其中,从头甲基化活动减弱并伴随Dnmt3b表达下调。Smad4取代Dnmt3b,接过TGFβ信号传递的“接力棒”,形成经典的Smad2/3-Smad4转录复合物。因此,S4KO细胞虽能启动上胚层的形成,但却阻滞在之后的原肠胚分化阶段。这些发现与小鼠胚胎的体内数据相一致。这项工作首次发现Dnmt3b是磷酸化的Smad2/3的新型互作因子,与Smad2/3共同决定干细胞命运,并阐明了信号传导和表观遗传的协同作用机制,进而为理解TGFβ信号在生理学和病理学中的作用提供了新的思路。
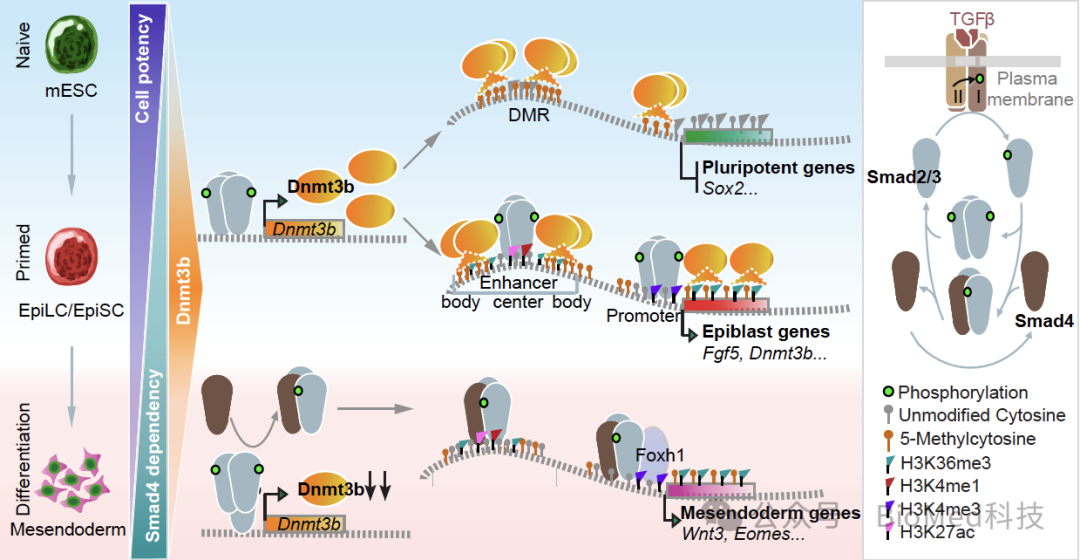
图1.干细胞在原始态-始发态-分化过程中的分步调控模型。首先,Smad2/3通过诱导 Dnmt3b的表达,主导干细胞从原始态到始发态的转变。一方面,Dnmt3b 确保从头DNA 甲基化模式的建立,并通过甲基化及时下调 Sox2 等多能性因子。另一方面,Dnmt3b 通过互作来促进Smad2/3与上胚层基因上的低甲基化中心结合,从而激活上胚层转化。其次,当上胚层向中内胚层分化启动时,Dnmt3b 下调,Smad2/3-Smad4形成经典的TGF转录复合物,结合并促进中内胚层基因的转录。
上海交通大学医学院王琼研究员,上海市免疫学研究所杜艳华助理研究员和上海交通大学生命科学技术学院章永春副教授为该论文的共同通讯作者。上海交通大学医学院赵冰楠硕士,于秀伟(在读博士),施金彤硕士,马双羽博士和李世召博士为该论文的第一作者。上海市免疫学研究所叶幼琼研究员为本研究提供了重要支持。
参考文献
1、David, Charles J., and Joan Massagué. "Contextual determinants of TGFβ action in development, immunity and cancer." Nat. Rev. Mol. Cell. Bio. 19.7 (2018): 419-435.
2、 Chu, Gerald C., et al. "Differential requirements for Smad4 in TGFβ-dependent patterning of the early mouse embryo." Development (2004): 3501-3512.
3、Bardeesy, Nabeel, et al. "Smad4 is dispensable for normal pancreas development yet critical in progression and tumor biology of pancreas cancer." Gene Dev. 20.22 (2006): 3130-3146.
4、 Wisotzkey, Robert G., et al. "Medea is a Drosophila Smad4 homolog that is differentially required to potentiate DPP responses." Development 125.8 (1998): 1433-1445.
5、 Zhao, B., Yu, X., Shi, J. et al. A stepwise mode of TGFβ-SMAD signaling and DNA methylation regulates naïve-to-primed pluripotency and differentiation. Nat Commun 15, 10123 (2024). https://doi.org/10.1038/s41467-024-54433-5
原文链接:
https://doi.org/10.1038/s41467-024-54433-5


