Biomaterials:陆军军医大学江虹/董世武团队合作研究了一种为股骨头骨坏死微创治疗的新策略
时间:2025-03-29 12:09:44 热度:37.1℃ 作者:网络
股骨头骨坏死(ONFH)是一个重大的临床挑战。尽管开发各种促进骨骼修复和延缓疾病进展的方法,但难以实现有效治愈。近期研究确定了一种非骨吸收破骨细胞亚型,血管相关破骨细胞(VAO),不同于经典的骨相关破骨细胞(BAO),VAO为ONFH提供了新的治疗机会。
2025年3月13日,陆军军医大学江虹、董世武共同通讯在Biomaterials上在线发表题为“An injectable hydrogel loaded with miRNA nanocarriers promotes vessel-associated osteoclast (VAO)-mediated angiogenesis and bone regeneration in osteonecrosis of the rat femoral head”的研究论文。作者观察到ONFH患者股骨头中VAOs和BAOs的种群和分布发生变化,表明这两种破骨细胞亚型之间的不平衡导致了ONFH的发生。该研究开发了一种可注射的藻酸盐/羟基磷灰石水凝胶(AHH),负载了基于氧化石墨烯的miR-7b纳米颗粒(GPC@miR)用于ONFH治疗。
AHH/GPC@miR中GPC@miR的可控释放通过抑制树突状细胞特异性跨膜蛋白(DC-STAMP)来抑制BAO形成,从而减少骨吸收。同时,单核/双核VAOs保留且数量增加,通过血小板衍生生长因子-BB(PDGF-BB)和血管内皮生长因子-A(VEGF-A)分泌促进H型血管生成和成骨。AHH/GPC@miR骨内给药重新平衡了VAOs和BAOs,恢复了股骨头微环境,并增强了ONFH大鼠模型的血管形成和骨再生。该研究通过调节破骨细胞亚型引入了一种基于生物材料的新型ONFH修复策略,为VAO介导的血管生成和骨再生的成骨提供了新见解。

皮质类固醇使用、酗酒、创伤、辐射暴露、高血压、血红蛋白病和自身免疫性疾病均有可能导致股骨头骨坏死(ONFH)。其中,皮质类固醇诱导的ONFH是最普遍的非创伤性形式,占病例的51%。这种疾病进展迅速,如果不治疗,大约94%的患者会在5年内出现股骨头塌陷或继发性髋骨关节炎。许多患者最终需要全髋关节置换术(THR),面临潜在的手术翻修负担。生物医学材料的进步为早期ONFH重建提供了潜在策略,虽然骨传导支架能够提供机械支持并改善血液供应,但由于股骨头微环境的破坏,其治疗效果仍然有限。因此,恢复骨内稳态可能是ONFH治疗的新方向。
骨骼系统通过成骨细胞、破骨细胞、内皮细胞和其他骨驻留细胞之间的相互协调来维持骨内微环境的稳定性。ONFH中,坏死区域的破骨细胞数量和活性显著升高,导致骨吸收过度。同时,成骨细胞凋亡或坏死会降低成骨细胞的数量和活性,从而延迟或损害新骨的形成。此外,局部血流受损限制了氧气和营养供应,进一步破坏细胞功能,触发级联效应,破坏骨内微环境的稳定性和功能。已有研究集中在血管再生和破骨细胞调节上,但尚未建立有效的通用治疗方法。
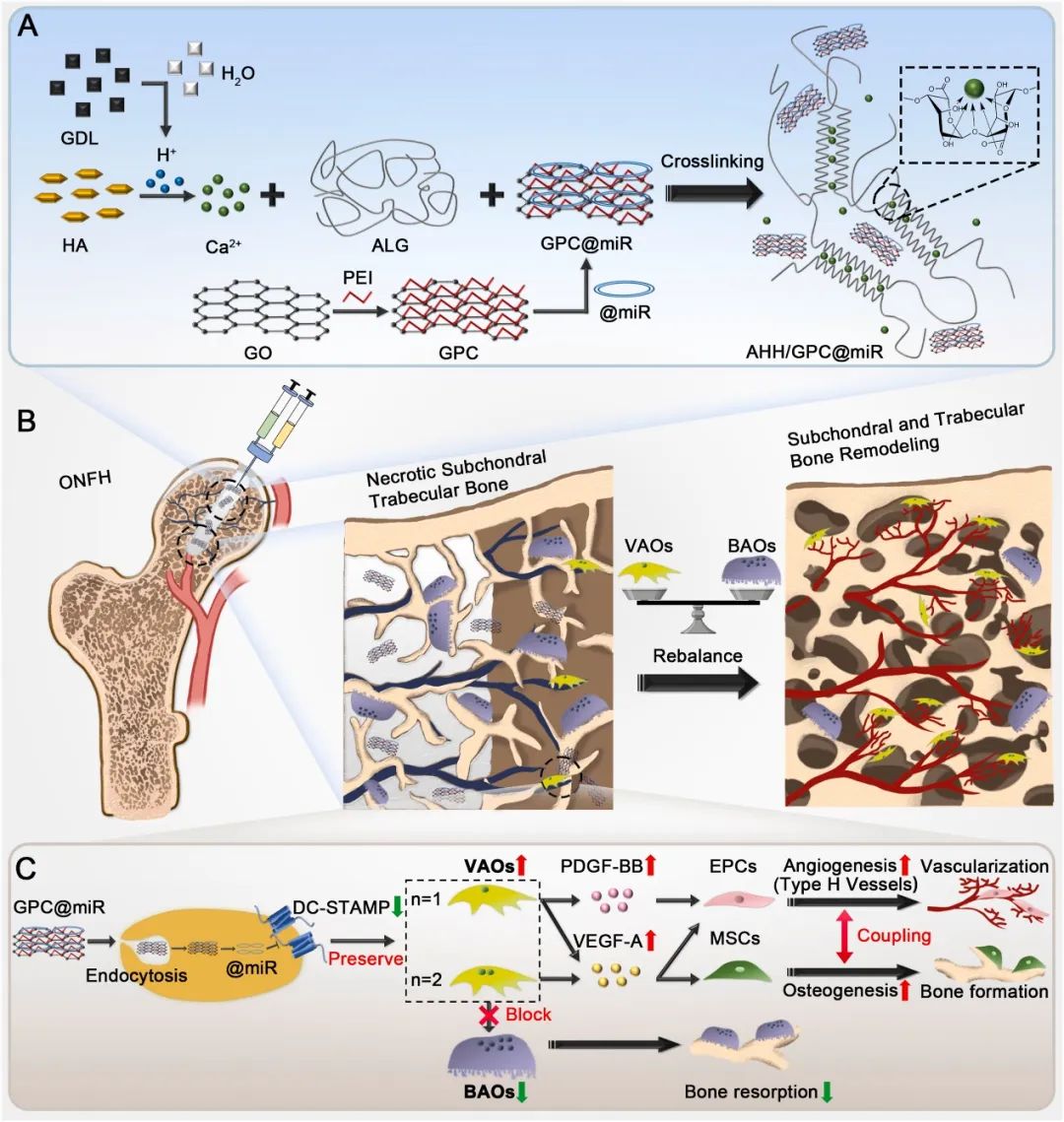
图1 AHH/GPC@miR的制备和作用机制示意图(摘自Biomaterials)
破骨细胞被认为是负责骨吸收的终末分化多核细胞。然而,近期研究发现了一种新的非吸收性破骨细胞亚型,即血管相关破骨细胞(VAO),其在形成过程中而不是吸收过程中填充骨骼。与位于骨小梁表面的骨相关破骨细胞(BAO)(60-100μm,每个细胞约4-6个细胞核)不同,VAO(15-20μm,每个细胞1-2个细胞核)位于干骺端区域的骨/软骨界面,并与H型血管密切相关。将VAOs移植到受辐射的小鼠中诱导VAO和BAO的形成,表明VAO可能是BAO的祖细胞。在骨形成过程中,VAOs在维持体内平衡和调节H型血管生长方面起着至关重要的作用。重要的是,该团队在接受THR的ONFH患者的股骨头组织样本中鉴定出了VAO和BAO。VAO和BAO群体的变化,以及H型血管分布的变化,表明VAO和BAOs的不平衡导致了ONFH病理学。该团队已有研究表明,miR-7b通过靶向树突状细胞特异性跨膜蛋白(DC-STAMP)特异性抑制破骨细胞融合,从而阻止多核破骨细胞形成。因此,作者假设选择性抑制BAOs的形成同时保留VAOs可能会增强偶联成骨中H型血管的生成。调控VAO和BAO群体有助于重建骨内微环境,促进ONFH中的血管化骨再生。
该研究开发了一种可注射的海藻酸盐(ALG)/羟基磷灰石(HA)水凝胶(AHH),用于递送载有过表达miR-7b质粒(GPC@miR)的聚乙烯亚胺(PEI)功能化氧化石墨烯(GO)复合物(GPC)。通过调节ALG和d-葡萄糖酸δ-内酯(GDL)浓度来微调AHH/GPC@miR的凝胶化和药物控释特性。核心减压(CD)联合局部AHH/GPC@miR注射作为ONFH大鼠模型的治疗策略。GPC@miR在股骨头内以受控方式释放,通过下调DC-STAMP抑制BAO形成,从而阻止破骨细胞骨吸收。同时,单核/双核VAOs保留且数量增加,通过分泌血小板衍生生长因子-BB(PDGF-BB)和血管内皮生长因子-A(VEGF-A)刺激H型血管生成和成骨。AHH/GPC@miR治疗平衡了骨微环境中的VAOs和BAOs,促进了ONFH大鼠的血管形成和骨再生。上述发现为ONFH微创治疗提供了一种新策略,靶向不同的破骨细胞亚型以恢复骨内稳态。
参考消息:
https://www.sciencedirect.com/science/article/pii/S0142961225001711?via%3Dihub


