内囊预警综合征(ICWS)
时间:2025-02-20 12:10:13 热度:37.1℃ 作者:网络
论坛导读:内囊预警综合征(Internal Capsule Warning Syndrome, ICWS)是指在24 h内反复出现至少3次刻板样发作的短暂性感觉和(或)运动缺失症状,一般累及包括面部和上肢或下肢中的2个或以上部位,无失语、视觉忽略、失用等皮质受累表现,容易进展为内囊梗死,而责任区域大血管通常无明显狭窄。该综合征临床相对较为少见,发病机制尚不明了,缺乏有效的干预手段。
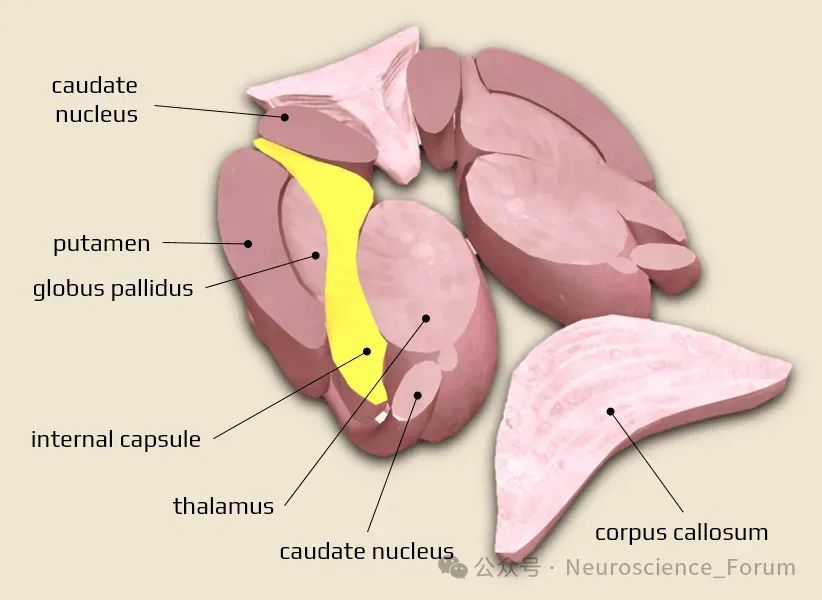
内囊预警综合征(Internal Capsule Warning Syndrome, ICWS)是一种以反复、短暂性局灶性神经功能缺损为特征的临床综合征,通常累及内囊区域,表现为短暂性运动或感觉障碍。Donnan于1993年首次提出ICWS,是指在24h内反复出现至少3次刻板样发作的短暂性运动和(或)感觉症状,累计包括面部和上肢或下肢中的2个及以上部位,无皮质受累表现(如失用、失语等)。近年来,随着影像学技术和治疗策略的进步,其研究也取得了一些重要进展。
ICWS是短暂性缺血发作(transient is chemic attack,TIA)的一种特殊类型,发生率约为1.5%,但较易进展为内囊部位梗死,因此又称为逐渐增强型TIA,约42%表现为CWS起病的TIA患者发病后经CT证实内囊部位存在相应的新发梗死灶,故命名为“内囊预警综合征”。其核心特点是症状反复发作(通常24小时内≥3次),且可能进展为完全性脑梗死。
一、病因与发病机制
关于ICWS的病理生理机制尚未完全明确。
1. 病因
动脉粥样硬化:最常见病因,累及大脑中动脉(MCA)深穿支(如豆纹动脉)或基底节区小动脉,导致内囊供血不足。
小血管病:高血压或糖尿病引起的小动脉玻璃样变性或微血栓形成。
心源性栓塞:心房颤动、心脏瓣膜病等导致微小栓子脱落,阻塞内囊区血管。
血流动力学障碍:低血压、血容量不足或血管狭窄导致的低灌注。
其他:高凝状态、血管炎、动脉夹层等。
2. 发病机制
微栓塞假说:动脉粥样硬化斑块破裂或心脏来源的微小栓子反复栓塞内囊区血管,导致短暂性缺血。
血流动力学波动:血管狭窄基础上,血压波动或血容量不足导致内囊区反复低灌注。
血管痉挛:局部血管舒缩功能障碍引发缺血。
缺血预适应与再灌注损伤:反复缺血可能加重局部组织损伤,最终进展为梗死。
穿支动脉病变是最为广泛接受的假说,这类病变也是TIA和脑梗死的重要病因之一。Camps Renom等进行了一项有关CWS的临床特点和预后的多中心研究,报道了42例ICWS患者,其中有31例患者的病因为穿支动脉病变。穿支动脉病变的引发原因也各有不同,常见的有大动脉粥样硬化阻塞穿支、穿支动脉本身粥样硬化、小动脉玻璃样变以及其他部位栓子脱落阻塞穿支等。
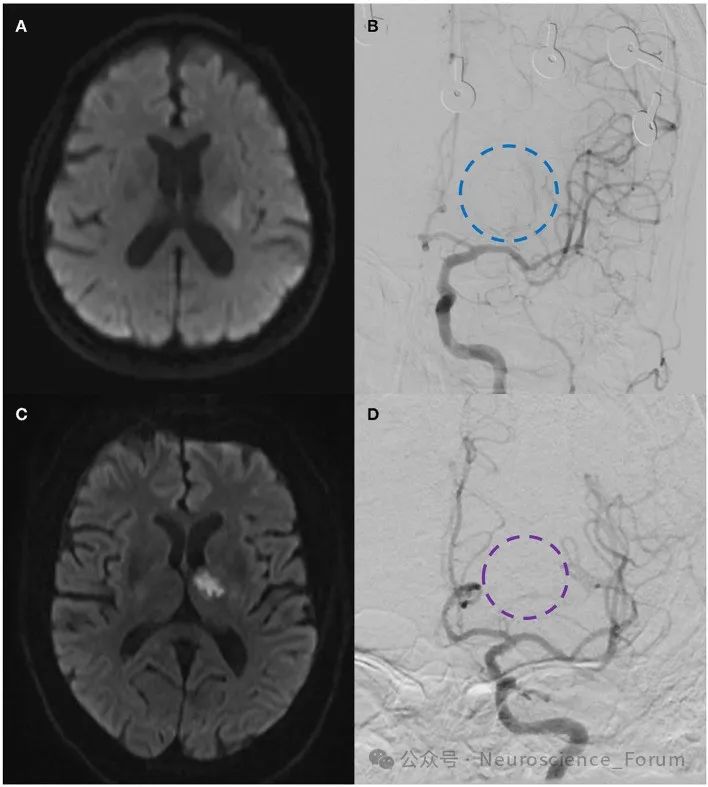
病理生理机制的新认识
-
微栓塞与血流动力学障碍并存:传统认为CWS是穿支动脉原位狭窄或闭塞所致,但新研究发现,部分患者存在微栓塞证据(如DWI高信号微小病灶),提示栓塞和低灌注可能共同作用。
-
内皮功能障碍与炎症:基础研究表明,血脑屏障破坏和炎症因子(如IL-6、TNF-α)升高可能加速内囊区缺血损伤。
-
基因易感性:某些基因多态性(如 RNF213 和 HTRA1 基因)可能与亚洲人群穿支动脉病变相关,增加CWS风险。
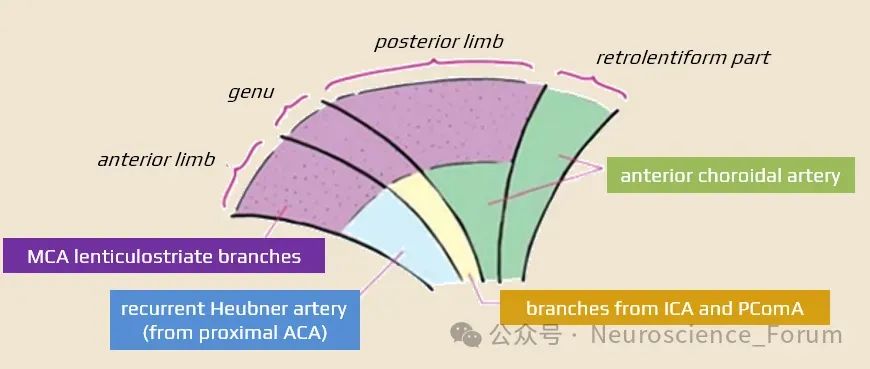
二、临床表现核心特征
-
短暂性、刻板性发作:每次发作症状相似,持续数分钟至1小时(通常<30分钟),24小时内≥3次。
-
运动障碍为主:对侧肢体无力(轻瘫或完全瘫痪)、笨拙,偶伴感觉障碍(麻木)。
-
无皮质症状:通常不伴失语、视野缺损或意识障碍(区别于皮质TIA)。
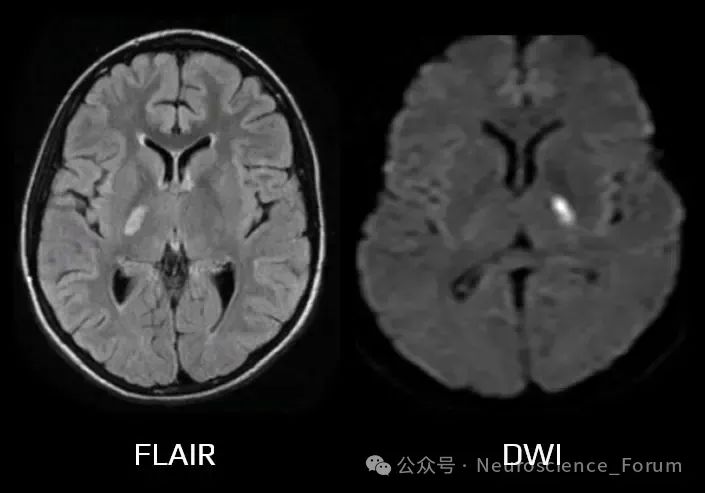
三、临床诊断
1. 诊断标准
临床三联征:
-
24小时内≥3次短暂性局灶性神经功能缺损;
-
症状累及内囊区(运动障碍为主);
-
排除其他病因(如癫痫、偏头痛、代谢异常)。
2. 辅助检查
-
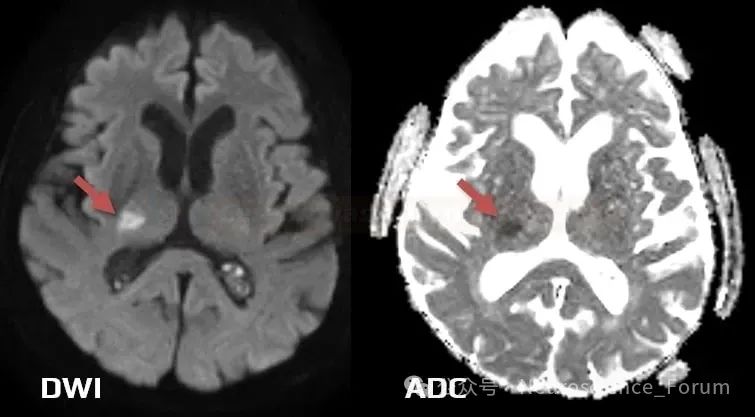
MRI-DWI:早期可能无梗死灶,但部分患者可见微小点状高信号(提示缺血损伤)。
-
血管评估:CTA/MRA/DSA检查大脑中动脉及穿支动脉狭窄或闭塞。
-
心脏评估:心电图、心脏超声排除心源性栓塞。
-
实验室检查:凝血功能、血脂、血糖、同型半胱氨酸等。
-
影像学诊断技术的突破
-
高分辨率MRI(HR-MRI):可清晰显示穿支动脉管壁病变(如脂质斑块或壁内出血),帮助区分动脉粥样硬化性与非动脉粥样硬化性病因(2021年《Neurology》)。
-
灌注成像(CTP/MRP):动态评估脑血流动力学,早期识别低灌注区域,指导溶栓或血管内治疗决策。
-
DWI-FLAIR不匹配:用于判断缺血发作时间,尤其在醒后卒中患者中具有价值(2023年Meta分析)。
四、临床治疗
1.紧急处理
-
抗血小板治疗:首选双重抗血小板(阿司匹林+氯吡格雷)短期联用(3~21天),降低卒中风险。长期单药维持(根据病因选择)。
-
抗凝治疗:若明确心源性栓塞,使用肝素或新型口服抗凝剂(NOACs)。
-
血压管理:避免过度降压(维持收缩压140~160 mmHg以保证灌注)。
-
扩容与改善血流:低灌注患者可适当补液或使用羟乙基淀粉。
2. 病因治疗
-
动脉狭窄干预:若发现大动脉狭窄(如MCA狭窄≥70%),考虑血管内治疗(支架或球囊成形术)。
-
控制危险因素:强化降压(目标<130/80 mmHg)、降脂(他汀类)、血糖管理。
3. 预防进展
密切监测:入院观察至少72小时,动态评估神经功能及影像学变化。
康复干预:急性期后尽早开始肢体功能康复。
治疗策略的优化
-
强化抗血小板治疗:
-
双联抗血小板(DAPT,如阿司匹林+氯吡格雷)在发病24小时内启动可能降低进展为脑梗死的风险。
-
替格瑞洛联合阿司匹林在难治性病例中显示出潜力。
-
早期溶栓的争议与进展:
-
即使症状波动,静脉溶栓(阿替普酶)在时间窗内(4.5小时)仍被推荐,部分研究显示可改善预后021年回顾性研究)。
-
超时间窗患者通过灌注成像筛选可能获益(DAWN/DEFUSE-3标准延伸应用)。
-
血管内治疗探索:针对大血管狭窄合并穿支病变的患者,血管成形术或支架置入术的个案报道增加,但证据有限。
五、预警的核心意义
卒中高风险信号:约30%~50%患者在数小时至数天内进展为完全性内囊梗死(如“内囊预警综合征→内囊梗死”)。提示不稳定血管病变:需紧急干预以预防不可逆脑损伤。内囊预警综合征的“预警”价值在于:
-
提示即将发生的卒中:频繁TIA是脑梗死的前兆,需紧急干预。
-
反映血管病变不稳定:可能预示动脉斑块破裂、血栓形成或栓塞风险极高。
-
时间窗紧迫:从首次发作到完全性卒中的间隔短(常<48小时),需争分夺秒治疗。
六、预后评估与生物标志物
-
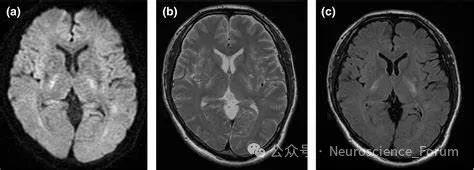
影像标志物:DWI病灶体积≥1.5cm³或累及内囊后肢提示预后不良(2022年多中心研究)。
-
血清标志物:GFAP(胶质纤维酸性蛋白)和神经丝轻链(NfL)升高与神经功能恶化相关,可能用于风险分层。
七、未来方向与挑战
-
个体化治疗:结合基因、影像和生物标志物制定分层治疗方案。
-
临床试验设计:需开展多中心RCT验证DAPT、溶栓扩展时间窗及血管内治疗的疗效。
-
人工智能辅助诊断:基于深度学习的影像分析工具(如自动识别穿支动脉病变)正在开发中。
六、总结
内囊预警综合征是神经科急症,其本质是内囊区反复缺血事件,需通过积极抗栓、控制危险因素及血管干预预防卒中。临床医生需高度警惕其“预警”意义,及时启动二级预防,最大限度降低致残率。目前关于内囊预警综合征的研究逐步从现象描述转向机制探索和精准干预,但核心挑战仍在于早期识别高危患者并阻止进展为完全性卒中。未来需整合多模态影像、分子生物学和临床数据,以优化治疗策略。


