【论文有声略读】血小板裂解液凝胶治疗高原难愈性创面一例
时间:2025-01-11 12:15:00 热度:37.1℃ 作者:网络
创面是一种常见的组织损伤,愈合过程复杂,且受外界环境、机体健康状况、创面微环境等多种因素影响。国际创伤学会将“无法及时完成正常而有序的修复过程、达到解剖和功能上完整状态的创面”定义为难愈性创面[1]。目前国内多数学者认为,由各种原因导致的经过1个月以上标准治疗仍未能愈合,也无愈合倾向的创面为难愈性创面[2]。在高原地区氧分压低、寒冷等严峻气候环境的影响下,创面易发展为难愈性创面,治疗难度大、周期长。
近年来,血小板裂解液(PL)因具有丰富的促修复活性因子而被广泛应用于组织再生。PL加入凝血酶后可制备成更符合创面治疗要求的凝胶形式即血小板裂解液凝胶(PLG)[3]。本文介绍1例采用PLG治愈的高原难愈性创面病例,并分析其作用机制,旨在为高原难愈性创面的有效治疗提供新思路。
病例资料
患者男性,22岁,因“虫咬伤1个月伴皮肤破溃不愈、加重伴行走受限”于2020年8月19日就诊于新疆阿里地区某中心医院普外科。患者入院3个月前进入海拔4500 m的高原工作,入院1个月前左小腿腓侧皮肤被不明昆虫叮咬,未行特殊处理,局部出现红肿及疼痛并日渐加剧,叮咬处皮肤逐渐形成点状破溃,使用碘伏、红霉素软膏涂抹未见好转,皮肤破溃(创面)面积持续增大,见血性分泌物渗出,且疼痛加剧,影响行走。入院后,诊断为“虫咬性蜂窝组织炎”,给予常规清创(双氧水、络合碘、生理盐水及呋喃西林冲洗创面)及抗感染(口服阿莫西林克拉维酸钾)治疗4周后,创面无明显愈合迹象。
查体:左小腿腓侧可见一大小约2.5 cm×2.5 cm,深约1 cm的创面,创面周围皮肤弥漫性红肿,呈蜂窝样缺损,创面表面可见血性分泌物渗出(图1),皮温较正常皮肤略高,触痛明显;左下肢行走受限,呈减痛步态。实验室检查:血常规示红细胞5.5×1012/L,血红蛋白140 g/L,白细胞5.9×109/L,血小板150×109/L。
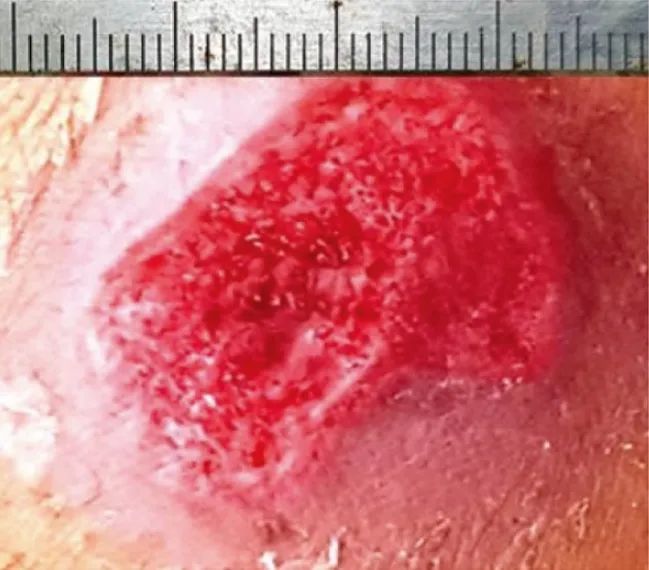
图1 血小板裂解液凝胶治疗前,患者创面大小约2.5 cm×2.5 cm,深约1 cm,周围皮肤弥漫性红肿,呈蜂窝样缺损,可见血性渗出物
诊断与治疗:结合病史、检查结果及诊疗经过,符合难愈性创面诊断标准,为高原难愈性创面。新疆军区总医院输血科受邀会诊,制定了自体血小板裂解液凝胶治疗方案。
自体血小板裂解液凝胶治疗方案:使用四联200 mL一次性使用去白细胞滤器血袋(上海输血技术有限公司,规格型号:TA-RFB T200)采集患者全血200 mL,在大容量低温离心机(ThermoFisher,Heraeus Cryofuge 16)4000×g离心10 min,离心后分三层,最上层为血浆层,最下层为红细胞层,中间薄层为白膜层。将2/3血浆层弃去后,剩余血浆层及白膜层置于转移袋中,并将红细胞保存液袋中的保存液挤入原袋中,与红细胞充分混合后回输至患者体内。
将转移袋再次210×g离心10 min,离心后将上层约30 mL血浆转移至红细胞保存液袋中,即为富血小板血浆(PRP)。将PRP置于-80 ℃低温冷冻24 h后,37 ℃水浴5 min快速解冻,重复完成3个-80 ℃/37 ℃冻融循环,再于室温下4000×g离心20 min,弃去下层血小板碎片,取上清液,使用0.2 μm无菌滤器(ThermoFisher),得到纯化的PL,均分成2份后置于-80 ℃储存,使用前37 ℃水浴3 min快速解冻。
取凝血酶冻干粉1支(500 U/支,长春雷允上药有限公司),加入5 mL葡萄糖酸钙(10%,国药准字:H51023153,四川美大康华康药业)注射液溶解,配置成100 U/mL的凝血酶溶液。将快速解冻的PL与凝血酶溶液按体积比9:1混合均匀,立即均匀平铺至无菌培养皿中,可见PLG形成,周围析出少量上清液,无菌注射器吸取上清液用于创面周围皮下注射。
彻底清创处理后,无菌纱布蘸干,将注射器内的上清液于创面周围少量、多点皮下注射(图2)。
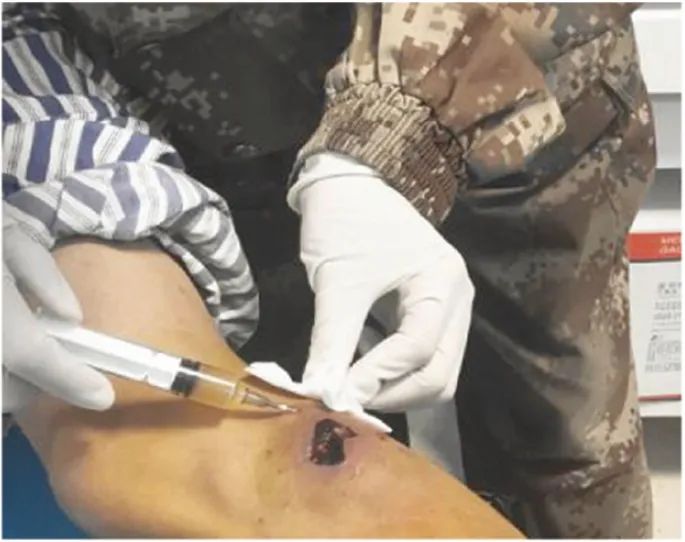
图2 于患者创面周围少量、多点皮下注射血小板裂解液凝胶上清液
继而采用无菌镊子夹取PLG覆盖创面(图3),再辅以凡士林油纱覆盖,维持创面湿度,外层使用普通干纱布包扎,间隔3 d重复治疗。
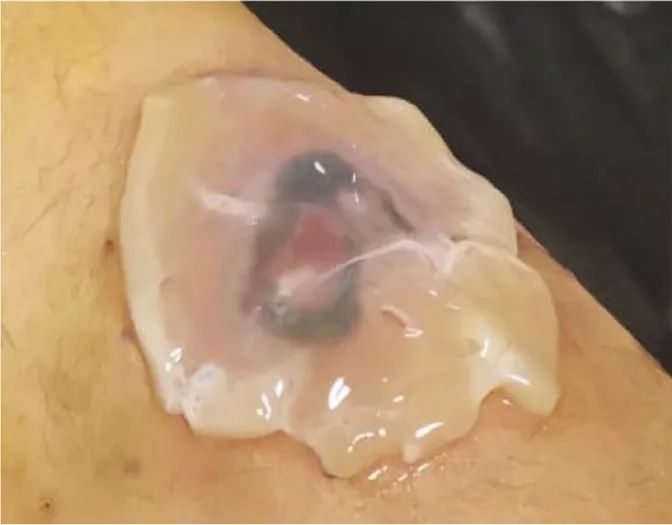
图3 血小板裂解液凝胶覆盖创面
治疗3 d后(图4A)去除纱布可见PLG呈薄膜状完全覆盖创面,创面部分愈合并结痂,红肿明显消退,无脓液渗出;治疗6 d后(图4B)创面结痂脱落,红肿消退;治疗9 d后(图4C)创面完全愈合。治疗期间患者疼痛较前减轻,未观察到感染、坏死或其他并发症。
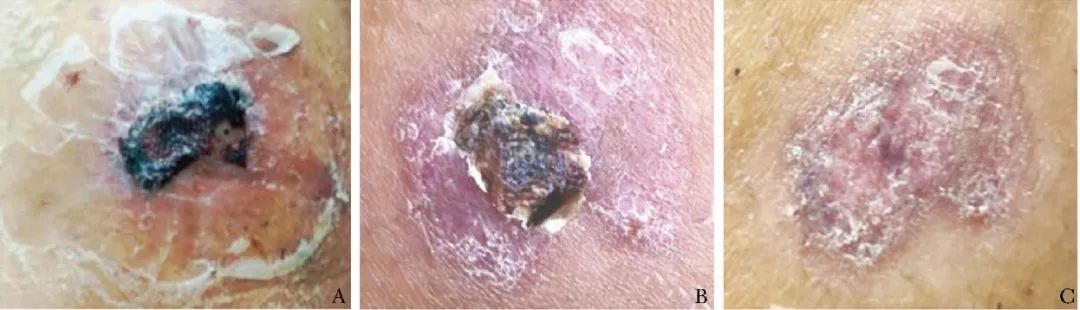
图4 血小板裂解液凝胶治疗后创面表观变化
A.治疗后3 d,创面部分愈合并结痂;B.治疗后6 d,创面结痂脱落,红肿消退;C.治疗后9 d,创面完全愈合
讨论
本例患者为青年男性,地处高原,虫咬伤后1个月创面未愈并逐渐加重,就诊后给予清创、抗感染治疗1个月无愈合迹象,符合难愈性创面诊断,考虑为高原难愈性创面。
创面修复是受多种因素影响、多细胞参与支持的动态过程,细胞功能的及时、有效启动在其中发挥至关重要的作用。同时,创面修复亦是一个高耗能的过程,需要充足的氧气以保证能量供应,然而即使在常氧环境中,由于局部代谢的成倍增长,加之脉管受损,氧气输送受阻,创面局部仍呈现相对“缺氧”的状态,修复过程往往受阻[4]。
高原地区缺氧、紫外线强、寒冷等不利因素进一步阻碍了创面修复进程[5],患者易陷入难以愈合的困境。在高原难愈性创面中,机体因“高原应激”导致细胞功能受损,细胞增殖、生长因子合成等修复反应受阻,且因绝对“缺氧”导致的供能不足及氧化应激反应进一步加剧了细胞功能损伤[5]。此外,高强度的紫外线及寒冷也会对创面造成理化损伤。
高原难愈性创面细胞功能损伤严重,导致清创引流、功能性敷料等多种传统创面治疗手段效果并不理想。该患者就诊后,每日给予清创及抗感染治疗,1个月后仍无明显愈合趋势。以血小板为基础的“生长因子-伤口愈合”治疗模式可促进细胞功能恢复[6-7],既往在糖尿病足的治疗中效果良好[8],为治疗高原难愈性创面提供了新思路。
PRP中血小板浓度为生理水平的3倍以上,血小板α颗粒及致密颗粒内丰富的生长因子、趋化因子等生物活性分子使得其具有组织再生能力。将PRP进一步通过冻融、超声破碎等裂解处理可得到PL,血小板处理后破裂,使得活性因子得到更大程度的释放。裂解后的离心过滤去除了PL中的细胞碎片,因而免疫原性低,安全性更好。
此外,PL可在-80 ℃长期储存,而PRP的保质期仅为5 d。PRP与PL均富含高浓度的生长因子,在难愈性创面治疗中均表现良好[9-10],但PL优点突出,在创面修复中更具应用前景[11]。该患者无血液系统疾病,生命体征平稳,血常规指标无异常,血红蛋白>110 g/L,血小板>150×109/L,符合自体血采集制备PL的要求,故为其定制了自体血PLG治疗方案。
液态PL受重力影响,在施用部位停留时间较短,故需将PL制备成胶状的PLG。PLG附着于局部组织,可延长作用时间,并能维持创面湿性愈合。
利用PL中的纤维蛋白原形成纤维凝胶是构建PLG的方法之一,首先,通过钙剂激活PRP中固有的凝血酶原,使其转化为凝血酶,可与外源补充的凝血酶共同促进纤维蛋白原转化为聚合紧密的纤维蛋白网络,启动胶凝过程,形成纤维凝胶[3,12];其次,可促发PL中未充分裂解的残余血小板发生释放反应[13],脱颗粒释放活性分子。凝胶的纤维结构可在一定程度上网络生长因子,控制生长因子的缓慢释放,延长活性分子的作用时间。PLG经过冻融裂解和激活剂的进一步作用,活性因子得到极大释放,富含多种生长因子,可通过促进细胞增殖、迁移、趋化、活化和分化等加快组织再生,在创面修复的临床研究[8,14]与基础研究中均取得了预期效果[15-16],同时还作为细胞培养的添加物被广泛研究[17]。
此外,通过与结构更稳定、机械性能更强的生物材料结合[18-19],还可形成更高效的PLG,但该类方法尚缺乏相应的临床应用证据。通过凝血酶及葡萄糖酸钙激活剂活化方式获得的PLG已有临床应用基础,且制备方法简便,是目前血小板制剂常用的胶凝方式,故本病例采用此方式制备PLG。
将制备PLG过程中析出的上清液通过创面周围(距离创面边缘1~2 cm)皮下多点注射的方式应用于患者创面,可在避免对创面造成机械损伤的前提下促进创面愈合。PLG上清液中高浓度的生长因子可实现创面局部生长因子的快速补充,促进创面细胞功能恢复,并通过PLG中的趋化因子和溶酶体颗粒抑制细菌生长,达到抗感染目的[20-21]。
注射后,将制备得到的PLG覆盖于患者创面,并加用传统伤口敷料包扎,在为创面提供活性因子的同时可维持湿性愈合。患者治疗后第3天疼痛即明显缓解,红肿消退,创面部分愈合并结痂,并于第9天实现完全愈合,可见PLG具有高效促进高原难愈性创面愈合的能力,为临床提供了良好借鉴。
注:本文发表已获得患者知情同意。
作者贡献
赵琴负责撰写论文;王海莹负责收集病例资料;王辉提出修改意见;张进进、邢颜超进行选题设计、指导论文写作并终审校对。
参考文献
[1]熊元, 曹发奇, 刘梦非, 等. 2023创伤骨科慢性难愈性创面诊疗指南: 治疗概要[J]. 临床外科杂志, 2024, 32(1): 49-52.
[2]王莎, 王超. 银离子敷料在慢性难愈性创面愈合中的抗菌作用及促进创面愈合疗效[J]. 中华实验外科杂志, 2021, 38(12): 2476-2479.
[3]Naskou M C, Tyma J F, Gordon J, et al. Equine platelet lysate gel: a matrix for mesenchymal stem cell delivery[J]. Stem Cells Dev, 2022, 31(17/18): 569-578.
[4]Younis I. Role of oxygen in wound healing[J]. J Wound Care, 2020, 29(Sup5b): S4-S10.
[5]何斯, 严辰媛, 刚乔健, 等. 高原地区难愈合创面病理变化和特点[J]. 医学综述, 2022, 28(14): 2746-2750.
[6]Acebes-Huerta A, Martínez-Botía P, Carbajo-Argüelles G, et al. Characterization of the molecular composition and in vitro regenerative capacity of platelet-based bioproducts and related subfractions[J]. Acta Biomater, 2024, 177: 132-147.
[7]Hosseini S, Soltani-Zangbar M S, Zamani M, et al. Comparative evaluation of autologous platelet-rich plasma and platelet lysate in patients with knee osteoarthritis[J]. Growth Factors, 2023, 41(3): 165-177.
[8]张进进, 王海莹, 黄永莉, 等. 血小板裂解液凝胶治疗糖尿病足的疗效观察[J]. 解放军预防医学杂志, 2020, 38(10): 68-70.
[9]OuYang H, Tang Y, Yang F, et al. Platelet-rich plasma for the treatment of diabetic foot ulcer: a systematic review[J]. Front Endocrinol (Lausanne), 2023, 14: 1256081.
[10]Alhawari H, Jafar H, Al Soudi M, et al. Perilesional injections of human platelet lysate versus platelet poor plasma for the treatment of diabetic foot ulcers: a double-blinded prospective clinical trial[J]. Int Wound J, 2023, 20(8): 3116-3122.
[11]赵琴, 张进进, 陈立力, 等. PDGF促进创面修复的研究进展[J]. 协和医学杂志, 2023, 14(6): 1289-1295.
[12]Fernández-Garibay X, Gómez-Florit M, Domingues R M A, et al. Xeno-free bioengineered human skeletal muscle tissue using human platelet lysate-based hydrogels[J]. Biofabrication, 2022, 14(4): 045015.
[13]Delgado Lagos F, Elgheznawy A, Kyselova A, et al. Secreted modular calcium-binding protein 1 binds and activates thrombin to account for platelet hyperreactivity in diabetes[J]. Blood, 2021, 137(12): 1641-1651.
[14]Lambadiari V, Kountouri A, Psahoulia F, et al. Treatment with umbilical cord blood platelet lysate gel improves healing of diabetic foot ulcer[J]. J Clin Med, 2024, 13(5): 1310.
[15]Ng S L, Azhar N A, Budin S B, et al. Effects of platelet lysate gels derived from different blood sources on oral mucosal wound healing: an in vitro study[J]. Gels, 2023, 9(4): 343.
[16]Mallis P, Michalopoulos E, Balampanis K, et al. Investigating the production of platelet lysate obtained from low volume Cord Blood Units: focus on growth factor content and regenerative potential[J]. Transfus Apher Sci, 2022, 61(6): 103465.
[17]Mareschi K, Marini E, Niclot A G S B, et al. A new human platelet lysate for mesenchymal stem cell production compliant with good manufacturing practice conditions[J]. Int J Mol Sci, 2022, 23(6): 3234.
[18]Tibourtine F, Canceill T, Marfoglia A, et al. Advanced platelet lysate aerogels: biomaterials for regenerative applications[J]. J Funct Biomater, 2024, 15(2): 49.
[19]Nazarnezhad S, Kermani F, Askari V R, et al. Preparation and characterization of platelet lysate (Pl)-loaded electrospun nanofibers for epidermal wound healing[J]. J Pharm Sci, 2022, 111(9): 2531-2539.
[20]Avellar H K, Lutter J D, Ganta C K, et al. In vitro antimicrobial activity of equine platelet lysate and mesenchymal stromal cells against common clinical pathogens[J]. Can J Vet Res, 2022, 86(1): 59-64.
[21]谢兴琴, 聂煜绮, 张怡. 生物材料人血小板裂解液在组织再生修复中的应用与作用[J]. 中国组织工程研究, 2022, 26(28): 4553-4561.


