迄今最大队列研究,NTRK融合中枢神经系统肿瘤靶向治疗疗效如何?
时间:2024-12-21 19:00:20 热度:37.1℃ 作者:网络
在不到 2% 的中枢神经系统肿瘤中检测到 TRK 融合。关于这些患者临床病程的数据有限。为此,对 TRK 融合驱动的 CNS 肿瘤患者进行了一项国际回顾性队列研究。识别了 119 例患者。诊断时的中位年龄为 4.5 岁。大多数患者的组织学符合高级别胶质瘤(HGG)的诊断(57.1%),其次是低级别胶质瘤(LGG)(27.7%)。儿童患者的预后较好,中位总生存期为 185.5 个月,而成人为 24.8 个月(p<0.0001)。与 HGG 相比,LGG 患者的预后更好(p=0.0012)。拉罗替尼的客观缓解率为 68.8%,而非靶向治疗为 38.1%。本研究表明,儿童 LGG 胶质瘤的预后优于成人和 HGG。TRK 抑制剂似乎可以改善肿瘤控制。
研究背景
NTRK1、NTRK2 和 NTRK3 基因编码原肌球蛋白受体激酶(TRK)受体 TRKA、TRKB 和 TRKC 家族,它们是神经营养性酪氨酸受体激酶(NTRK)蛋白。这些受体在神经元组织中表达,在神经系统的正常发育和功能中发挥重要作用。NTRK 基因融合已在多种儿童和成人肿瘤中报道,当编码酪氨酸激酶结构域的 NTRK 基因的 3' 区通过染色体内或染色体间重排与融合伴侣基因的 5' 端在框内连接时发生。由此产生的融合癌基因导致嵌合蛋白的表达,该蛋白保留酪氨酸激酶结构域,具有组成型活性,驱动下游信号转导。
NTRK 基因融合发生在高达 1% 的实体瘤和 2% 的成人原发性中枢神经系统(CNS)肿瘤中。在儿童人群中,在高达 5.3% 的高级别胶质瘤(HGG)和 2.5% 的低级别胶质瘤(LGG)中观察到 NTRK 基因融合。最近,在 2021 WHO CNS肿瘤分类中,具有 NTRK 基因融合的胶质瘤亚群被归类为婴儿型半球胶质瘤。
文献中关于 NTRK 融合 CNS 肿瘤的数据有限,主要在病例报告和小型病例系列中介绍,或包含在关注儿童 CNS 肿瘤分子特征的大型研究中。最大的队列包括 33 例参加两项临床试验,接受选择性 TRK 抑制剂(TRKi)拉罗替尼治疗的患者。拉罗替尼和恩曲替尼已获 FDA 和 EMA 批准用于 NTRK 融合阳性实体瘤患者,并且慢慢开始影响 NTRK 融合 CNS 肿瘤的管理。然而,NTRK 融合阳性 CNS 肿瘤患者的自然病程和结局尚未得到很好的描述。更好地了解这些罕见肿瘤将有助于解释与这些新的靶向治疗方法相关的疗效和局限性。在此,我们报告了大型国际队列中携带 NTRK 融合的 CNS 肿瘤儿童和成人患者的特征和结局。
研究结果
研究人群
识别了来自 46 个中心(21 个国家)的 129 例 NTRK 融合 CNS 肿瘤患者。10 例报告有 NTRK 改变的患者被排除在外,因为无法确认他们的肿瘤是否存在 NTRK 融合;因此,该队列包括 119 例患者。31 例患者(26.1%)既往已在文献中报道,作为临床试验、病例系列或病例报告的一部分。
整个队列的中位随访时间为 38.5 个月(范围 0.03-229.3 个月)(表 1)。诊断时的中位年龄为 4.5 岁(范围 0-78.4 岁),几乎一半的患者是 3 岁以下的婴儿(n= 53/117,45.3%)。成人队列的中位年龄为 50 岁(范围 18-78.4 岁)。
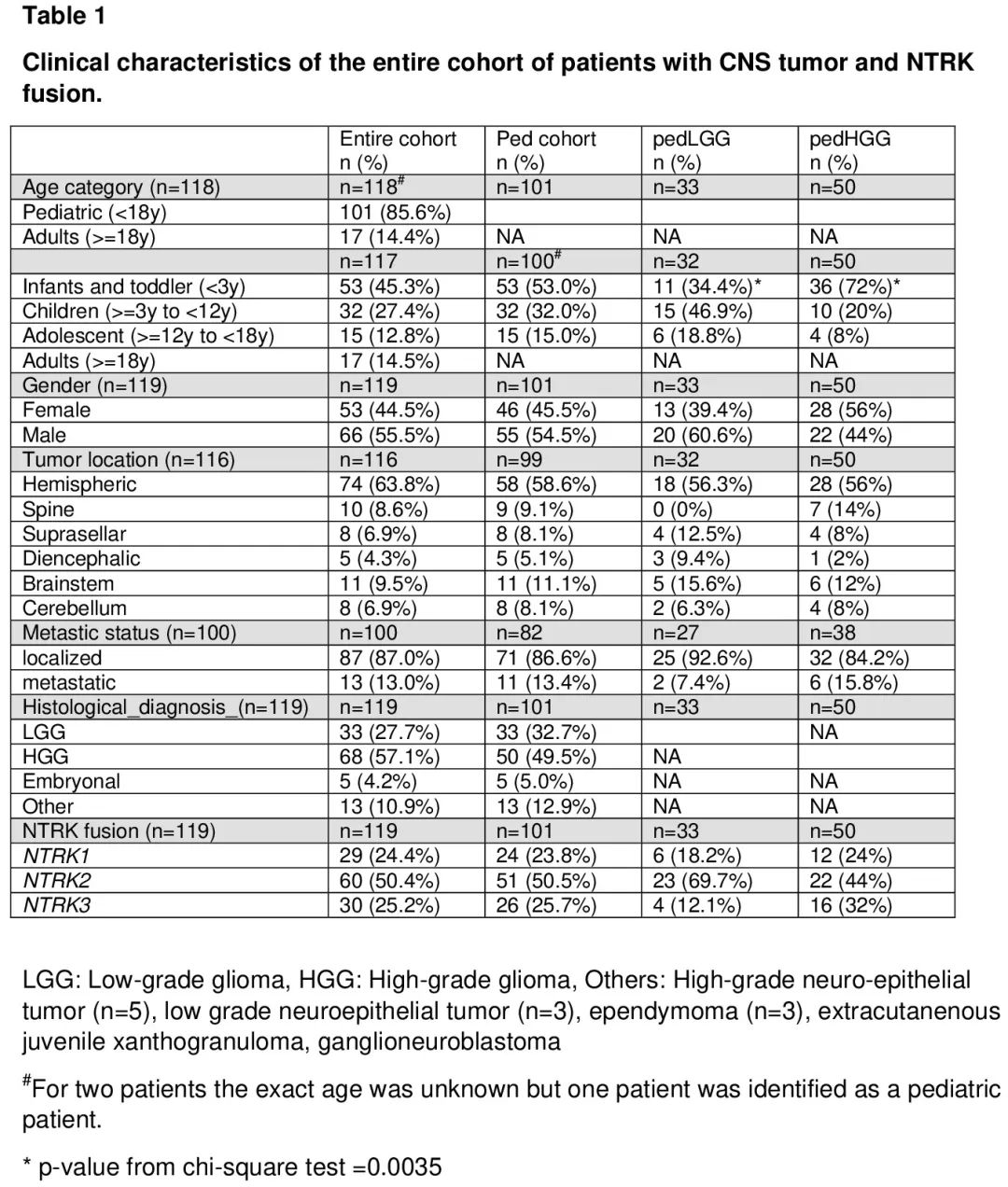
表1
肿瘤特征
NTRK 融合 CNS 肿瘤最常见的位置是半球(63.8%)。13 例患者(13%)有转移性疾病(表 1)。大多数患者的组织学符合 HGG 的诊断(57.1%),其次是 LGG(27.7%)、胚胎性肿瘤(4.2%)和其他(10.9%)(表 1)。所有 17 例成人患者均被诊断为 HGG。在儿童中,LGG 和 HGG 根据年龄分布不同,HGG 主要见于 3 岁以下的患者(72%,p=0.0035)(表 1)。大多数患者携带 NTRK2 融合(50.4%)(图 1)。特定 NTRK 基因(NTRK1、2 或 3)与特定组织学无关。对原发部位使用 NGS 检测 NTRK 融合和其他改变。
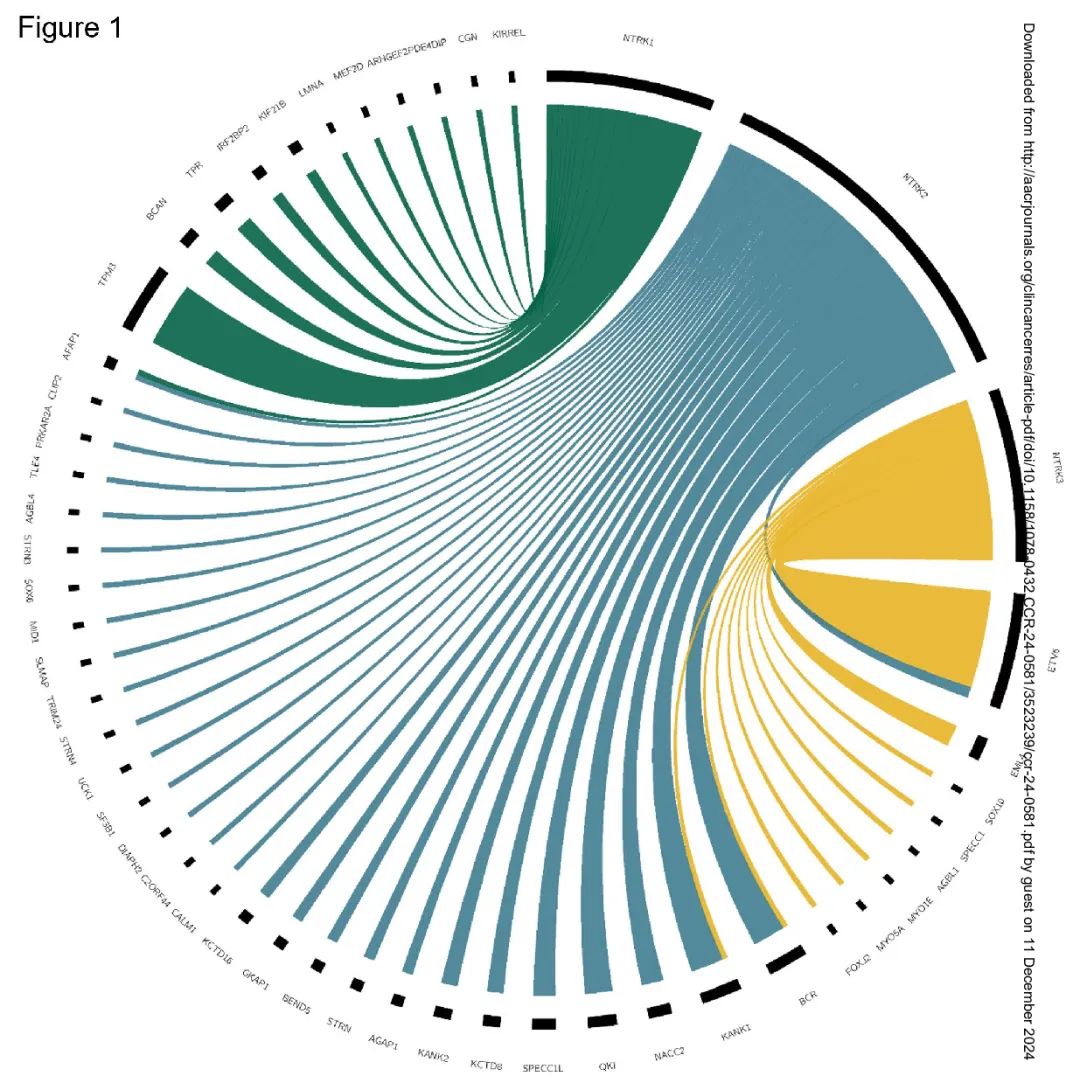

图1
治疗
关于初始治疗,40 例患者(33.6%)仅接受手术,随后进行观察,没有进一步治疗,72 例患者(60.5%)接受了化疗、放疗或其他全身治疗,不包括 TRKi,7 例患者(5.9%)接受了初始 TRKi 治疗(表 2)。
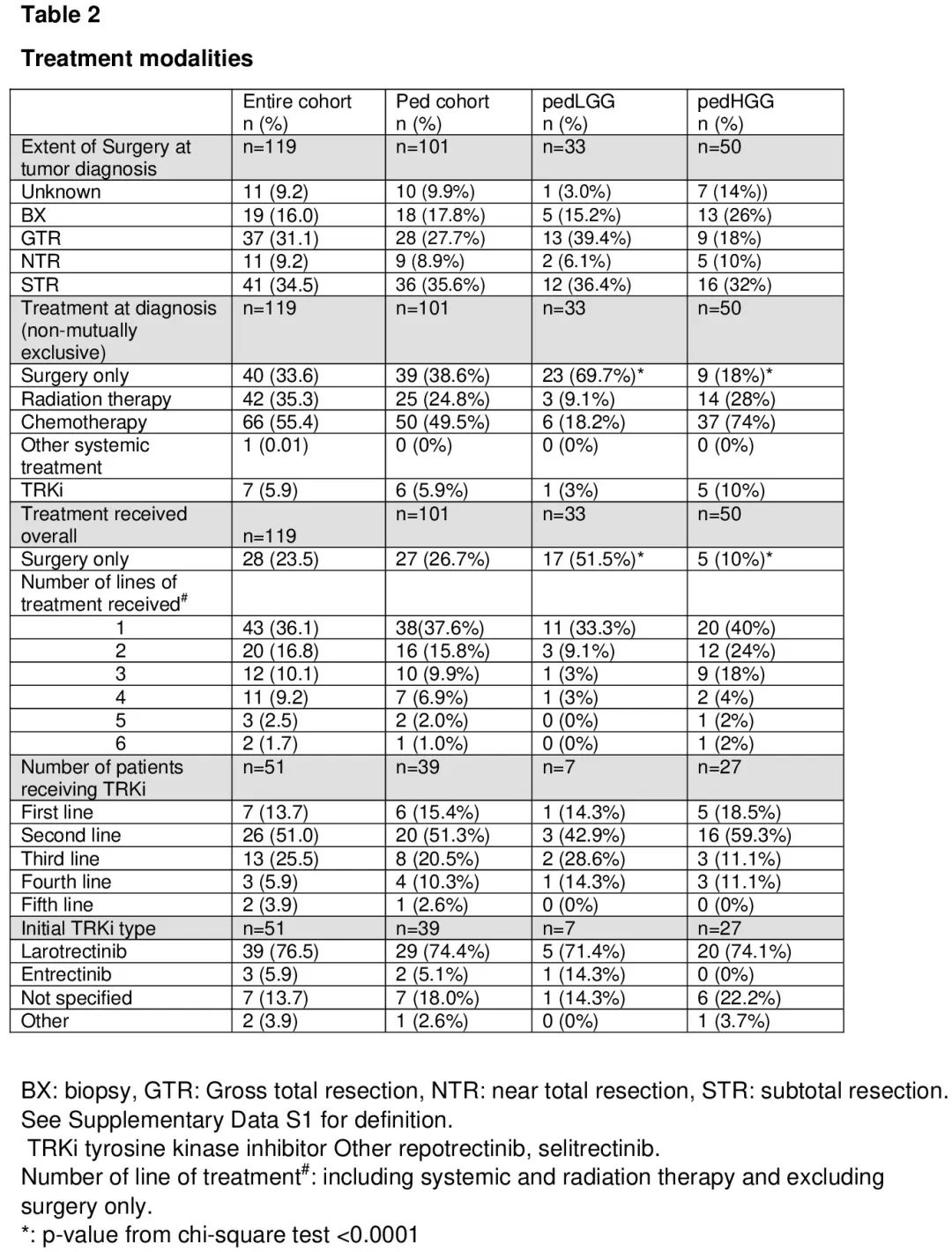
表2
评估观察期间接受的治疗,28 例患者(23.5%)仅接受手术,没有进一步治疗,这些患者中大多数是儿童 LGG 患者(60.7%),17.9% 是儿童 HGG(p<0.0001)。43 例患者(36.1%)除手术外还接受了一种治疗,48 例患者(40.3%)接受了三种或以上治疗(表2)。51 例患者(42.9%)在随访期间的某个时间点接受了 TRKi 治疗,包括 39 例(76.5%)接受拉罗替尼,3 例(5.9%)接受恩曲替尼,9 例(17.6%)接受其他或未说明的 TRKi(表 2)。第一位接受 TRKi 的患者是在 2015 年接受的治疗。4 例患者接受了 2 种不同的 TRKi,据报道 1 例患者接受了 3 种不同的 TRKi。16 例患者(13.4%)参加了 TRKi 的治疗性临床试验;8 例接受拉罗替尼(其中 2 例随后接受了 selitrectinib),3 例接受恩曲替尼,5 例接受未说明的 TRKi。
治疗疗效
65 例患者共接受了 99 线非靶向治疗,评估了 63/99 线治疗的疗效。在这 63 线可评估的非靶向治疗方案中,24 线(38.1%)导致客观缓解 [10 CR(完全缓解),13 PR(部分缓解),1 MR(轻微缓解)]。对于 35 线可评估的非靶向方案,儿童 HGG 客观缓解率为 42.9%(6 CR,8 PR,1 MR)。在 31 线可评估的非靶向方案中,婴儿(<3 岁)HGG 客观缓解率为 45.2%(6 CR,7 PR,1 MR)。在 4 线可评估的非靶向方案中,年龄较大的儿童/青少年 HGG 客观缓解率为 25%(1 PR)。
在总体 33 例患者和 21 例儿童患者中,对 TRKi 的反应可评估。总体缓解率为 42.4%(5 CR,7 PR,2 MR),儿童患者缓解率为 61.9%(4 CR,7 PR,2 MR)。当仅限于 HGG 患者时,22 例患者对 TRKi 的反应可评估,总体缓解率为 45.5%(5 CR,4 PR,1 MR),儿童缓解率为 90%(4 CR,4 PR,1 MR)。
22 例儿童患者共接受了 23 线拉罗替尼治疗,评估了 16/23 线治疗的反应。在这 16 线可评估的拉罗替尼方案中,11 线(68.8%)显示客观缓解(4 CR,5 PR,2 MR)。当仅限于儿童 HGG 患者时,8 例患者对拉罗替尼的反应可评估,缓解率为 100%(4 CR,3 PR,1 MR)。
生存结局
中位随访时间为 38.5 个月(范围:0.03-229.3)。在最后一次随访中,88 例患者(74%)存活。分析了整个队列和不同特征患者的总生存期(OS)和无进展生存期(PFS)(图 2 ,图 3)。整个队列的中位 OS 为 185.5 个月(95% CI 99.5-229.3)(图 2A),中位 PFS 为 25.5 个月(95% CI 15.5-40.9)(图 3A)。未观察到全切除(GTR)和近全切除(NTR)的 OS(p=0.45)或 PFS(p=0.40)优于部分切除或活检。
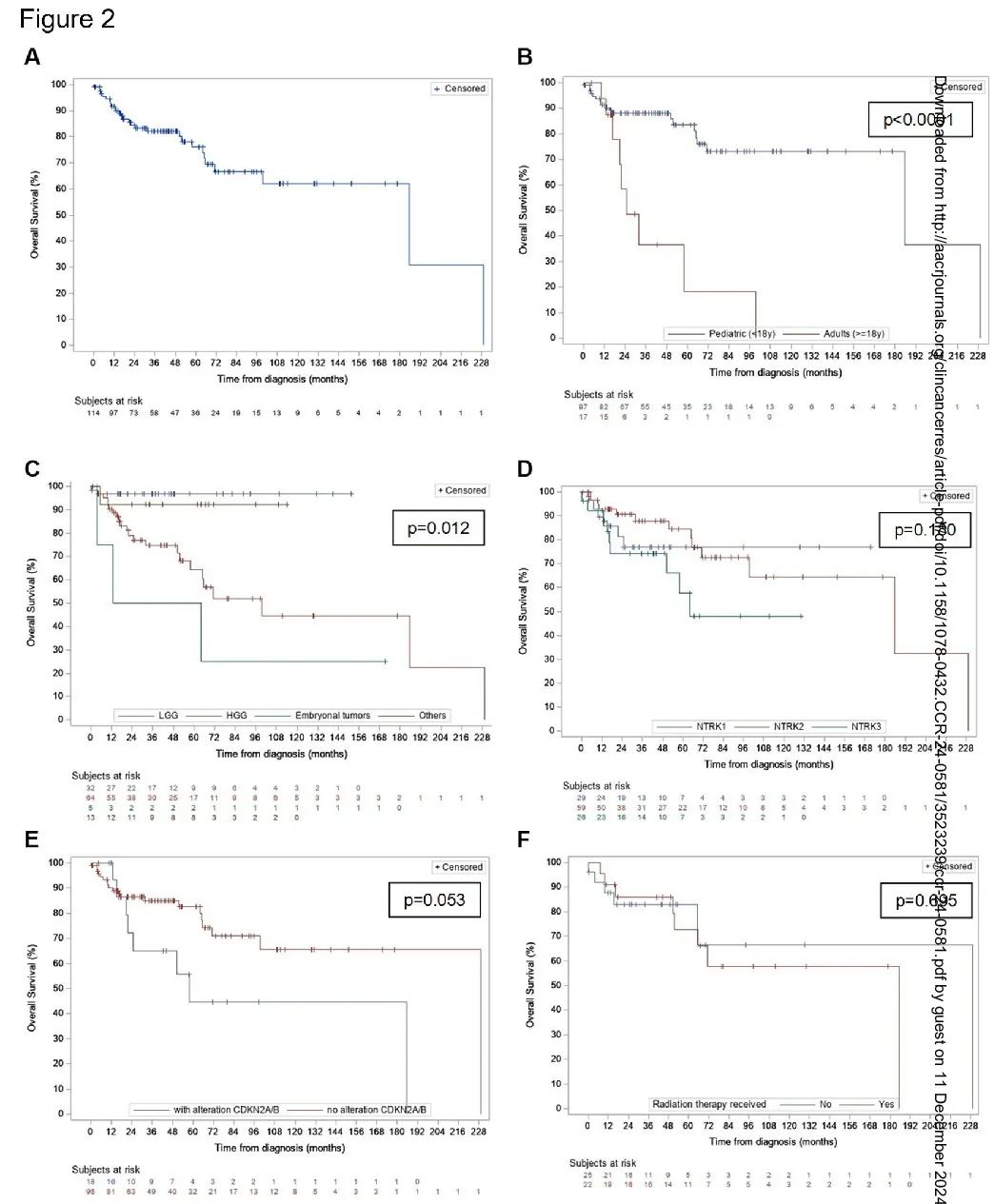

图2
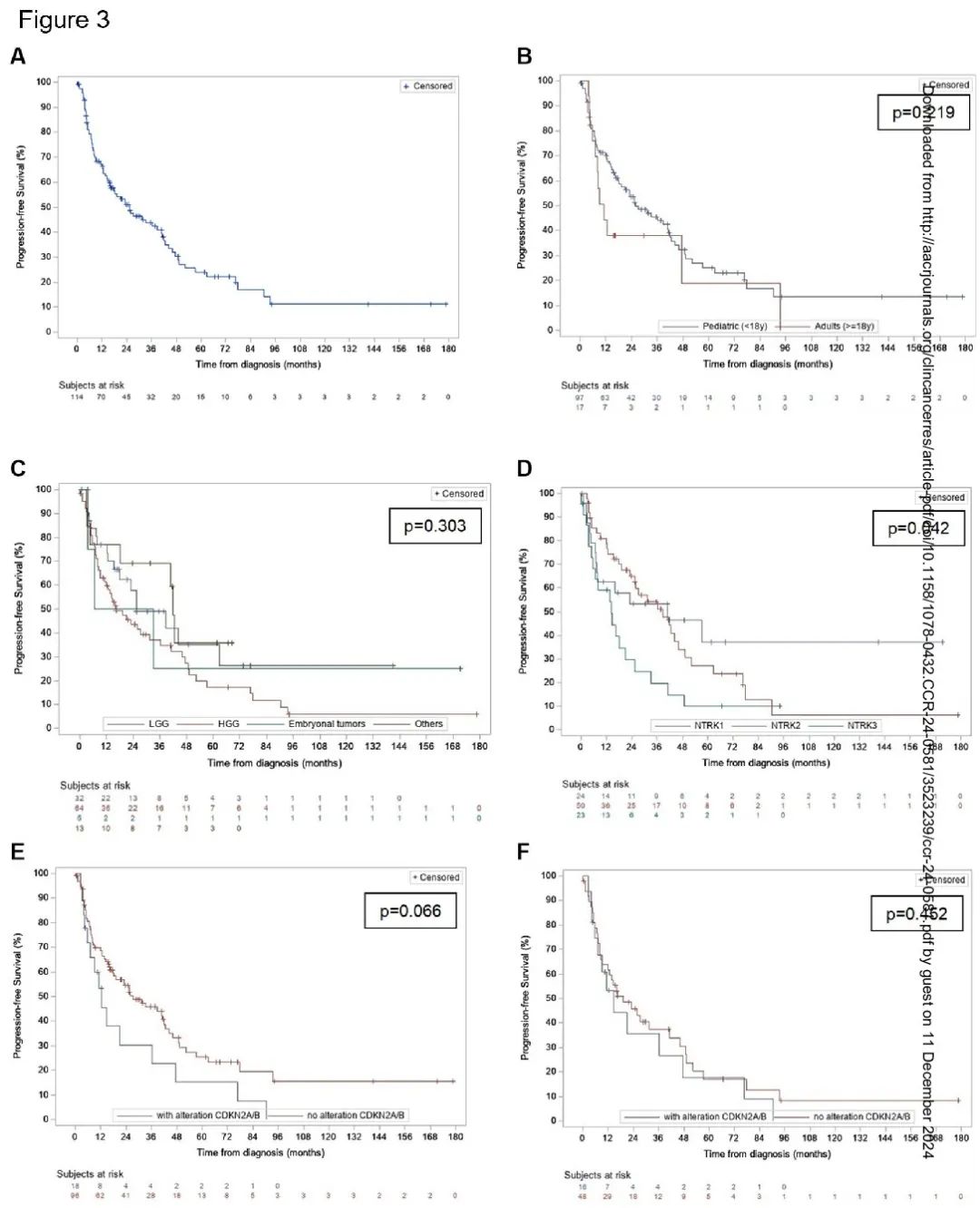

图3
儿童患者的预后更好,中位 OS 为 185.5 个月(95% CI 185.5-229.3),而成人为 24.8 个月(95% CI 17.1-99.5)(p<0.0001)(图 2B)。然而,儿童和成人患者的中位 PFS 没有显著差异(分别为 25.8 个月和 11.1 个月,p=0.22)(图 3B)。LGG 患者的预后也更好,中位 OS 未达到,优于 HGG 的 99.5 个月(95% CI 57.9-229.3)和胚胎性肿瘤的 38.5 个月(95% CI 3.5-NE 不可估计)(图 2C)。这种不同组织学的 OS 差异在儿童队列中也显著(p=0.021)。儿童 HGG 患者的预后优于成人 HGG 患者。儿童 HGG 的中位 OS 为 185.5 个月(95% CI 65.3- NE),而成人为 24.8(95% CI 17.1- NE)个月(p=0.0035)。不同组织学亚型的 PFS 没有差异(p=0.30)(图 3C)。6 例 HGG 患者仅接受了手术,2 例在最后一次随访时仍存活(范围 28.7-43.7 个月)。不同 NTRK 基因融合类型(1,2 或 3)的 OS 没有差异(p=0.18)(图 2D)。NTRK1 或 NTRK2 儿童患者的 PFS 有较优的趋势(NTRK1 vs NTRK3 的 p=0.0526,NTRK2 vs NTRK3 的 p=0.0214)(图 3D)。CDKN2A/B 改变患者的中位 OS 为 57.9 个月,无改变患者为 229.3 个月(p=0.053)(图 2E)。大多数 CDKN2A/B 改变患者的诊断为 HGG(16/18-88.9%)。有和无 CDKN2A/B 改变的患者的 PFS 没有显著差异(图 3E-F)。只有 1 例 LGG 患者存在 CDKN2A/B 缺失。该婴儿有一个小脑病变,接受了两次切除,没有进行全身治疗或放疗,随访 57 个月时仍然存活。最后,在接受或未接受放疗的儿童 HGG 患者中未观察到 OS 差异(p=0.695)(图 2F)。
生长调节指数
计算 31 例患者(20 例儿童和 11 例成人)的生长调节指数(GMI)。GMI 定义为治疗的 PFS 与既往治疗的进展时间(TTP)的比值(治疗的PFS/既往治疗的TTP)。通常认为,GMI ≥1.3 提示显著的治疗获益,二线治疗的 PFS 增加 30% 或以上。20 例患者被排除在分析之外(11 例接受 TRKi 加另一种治疗,5 例在 TRKi 之前未接受治疗,2 例没有数据,2 例接受 TRKi 治疗但既往无进展)。中位 GMI 为 1.1(范围 0.09-11.51),15/31(48.4%)的 GMI≥1.3。对于儿童人群,中位 GMI 为 1.36(范围 0.15-11.51),10/20(50.0%)的 GMI≥1.3。8 例患者(40%)在最后报告的时间点仍在接受 TRKi。平均 TRKi 治疗时间为 26 个月,没有无进展的患者停止治疗。对于儿童 HGG 亚组(N=12),中位 GMI 为 0.6(范围 0.15-7.58),4/12(33.3%)的 GMI≥1.3。
Kaplan-Meier 估计,在儿童患者中,TRKi 的 GMI ≥1.3 的概率为 0.62(95% CI = 0.36,0.80)[在儿童 HGG 亚组(N=12)中为 0.44(95% CI = 0.15,0.70)],在成人患者(N=11)中,为 0.45(95% CI = 0.17,0.71)。因此,与既往治疗相比,接受 TRKi 治疗的儿童患者的 PFS 更好(图 4A)。然而,在儿童 HGG 亚组和成人患者中未观察到这种差异(图 4B)。
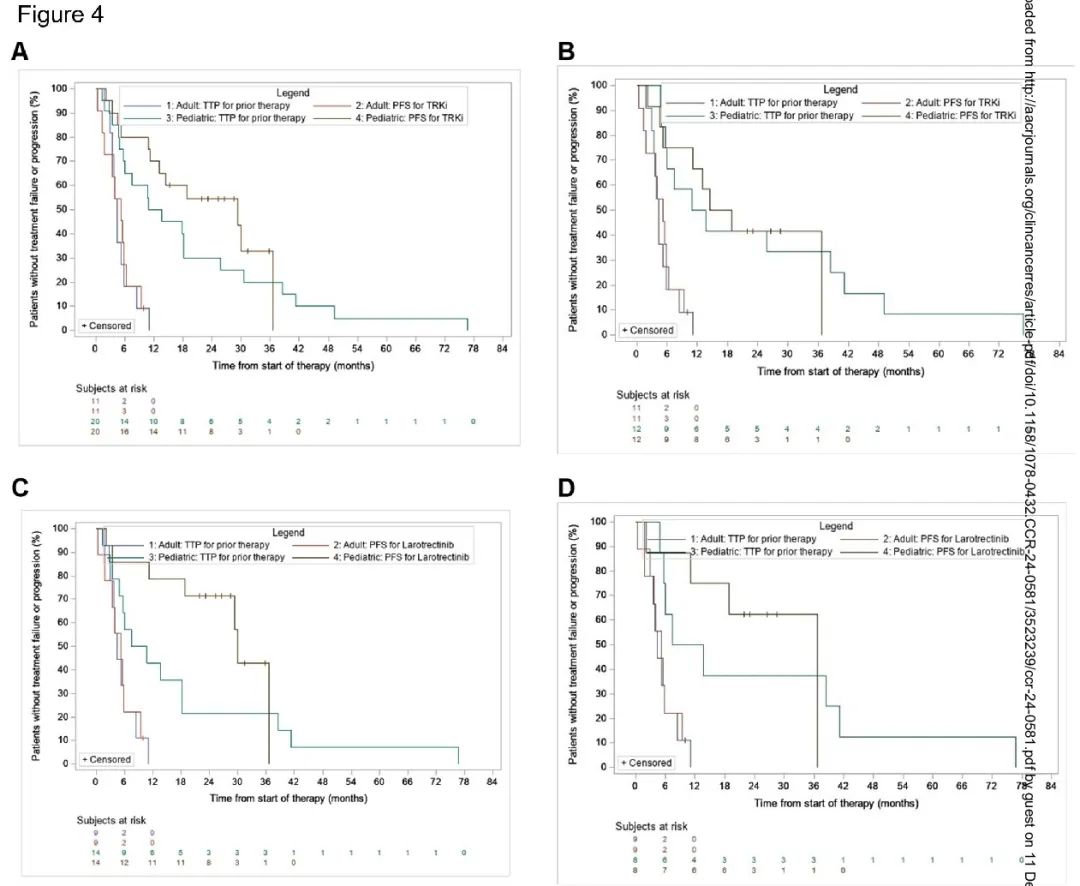

图4
关于拉罗替尼,在 23 例患者(14 例儿童和 9 例成人)中,中位 GMI 为 1.66(范围 0.09-11.51),14/23(60.9%)的 GMI≥1.3。对于儿童人群,中位 GMI 为 2.11(范围 0.15-11.51),10/14(71.4%)的 GMI≥1.3。由于儿童亚组中可用于此分析的 LGG 患者数量较少,因此无法比较儿童 LGG(N=2)与 HGG(N=8)的中位 GMI。对于儿童 HGG 亚组(N=8),中位 GMI 为 1.3(范围 0.15-7.58),4/8(50.0%)的 GMI≥1.3。
使用 Kaplan-Meier 估计,拉罗替尼的 GMI≥1.3 的概率在儿童患者为 0.85(95% CI = 0.52,0.96)[ 该概率在儿童 HGG 亚组(N=8)为 0.73(95% CI = 0.28,0.93)],在成人患者(N=9)中为 0.44(95% CI = 0.14,0.72)(图 4C 和 4D)。在儿童患者(包括儿童 HGG 亚组)中,拉罗替尼的 PFS 优于既往治疗,但在成人患者中未观察到这种差异(图 4C 和 4D)。
讨 论
据我们所知,本研究展示了最大的确认 NTRK 融合的 CNS 肿瘤患者队列。结果显示,儿童患者和 LGG 肿瘤患者的总生存期更好。此外,证据表明,与既往疗法相比,TRKi 可能带来更高的缓解率和 PFS,尤其是在儿童中。
与成人相比,儿童患者的预后显著更好,中位 OS 超过 15 年,而成人为 2 年。然而,儿童队列包括不同组织学,而成人队列都是 HGG。在 HGG 中,成人的结局更差。我们的观察结果与 SCOUT/NAVIGATE 试验报告的一致。在接受拉罗替尼治疗的患者中,40% 的儿童达到部分缓解,而成人无人达到部分缓解。在正在进行和未来的临床试验中,这种结局差异将非常重要。在本研究中,未识别可以解释这种差异的其他风险因素。由于未进行集中检测,因此本数据集未报告区分儿童肿瘤和成人肿瘤的其他分子改变。然而,NTRK 融合可能是成人 CNS 肿瘤病理生理学中的晚期事件,或者是成人肿瘤中的多种致癌突变之一,而在儿童中 NTRK 融合被认为是主要驱动突变。为了回答这个问题,需要收集下一代测序数据和 DNA 甲基化谱,并与结局相关联。
虽然我们承认胶质瘤分级可能具有挑战性,尤其是在幼儿中,但我们的数据显示,在携带 NTRK 融合的 CNS 肿瘤中,基于组织学的分级似乎仍然是结局的重要预测因子。这一概念需要通过组织学、分子特征和甲基化分析的集中审查来验证。
本队列中,NTRK1 儿童患者的 PFS 有较优的趋势。这一观察结果在其他癌症中未报道,可能没有临床意义。然而,应在未来的队列研究和临床试验中探讨这一结果。我们的研究表明融合伴侣没有差异,但也需要前瞻性随访以确认融合伴侣没有意义。
在本研究中,近四分之一的患者,包括 2 例 HGG 患者,仅接受了手术,获得长期生存。基于这一观察结果,对于一些接受全切除的患者,包括儿童 HGG 患者,在开始全身治疗之前,或许可以谨慎观察,考虑到 OS 出色(中位 OS 185.5 个月)。我们没有观察到接受放疗的儿童 HGG 的结局优于未接受放疗的患者。因此,使用放疗的决定应与潜在的副作用进行平衡(尤其是对幼儿)。此外,鉴于观察到的 TRKi 的 GMI 和较高的缓解率,在某些儿童 HGG 中考虑有限切除,并提供 TRKi 作为初始治疗可能是合理的。与全身治疗相比,接受拉罗替尼治疗的 HGG 的缓解率和 GMI 特别高,疗效显著更高。初始 TRKi 治疗正在研究中(NCT04655404)。
超过一半的儿童 LGG 仅接受了手术,这在意料之中。与过去 LGG 数据相比,携带 NTRK 融合的 LGG 似乎没有更高的风险,不需要额外治疗。然而,鉴于其中一些病变可能难以切除,应避免神经功能缺损风险高的手术。在这些特定的 LGG 病例中,应考虑标准化疗,TRKi 可能提供一种有趣的替代方案,尤其是在疾病复发的情况下。鉴于可用于反应分析和 GMI 的 LGG 数量较少,无法得出 TRKi vs 化疗疗效的结论。
在回顾性队列中评估治疗效果具有挑战性。反应的评估不是集中的,而是基于当地研究者的评估。临床实践并不总是遵循正式的 RANO/RAPNO 疗效标准。尽管如此,我们观察到,在儿童患者中,拉罗替尼的缓解率高于非靶向治疗,提示这种治疗方法可能产生临床益处。其他 TRKi 的疗效无法评估,因为患者数量少。
比较不同时间点的缓解率也是一个重大局限。多次复发的患者对治疗产生反应的概率较低。GMI 是一种创新方法,适用于复发和难治性癌症。其临床应用已被接受,用于评估使用患者内部对照的治疗效果。对于出现进展的患者,有效的治疗应增加下一次进展时间。在我们的研究中,接受拉罗替尼治疗的儿童患者的 GMI 为 2.1,显著高于与潜在疗效相关的 1.33 GMI 阈值。虽然是武断的,但这个 33% 改善阈值似乎是合适的,因为在其他实体瘤中后续全身治疗的 PFS 往往较低。截至数据截止日期,许多纳入的患者仍在接受治疗,提示中位 GMI 可能会进一步增加。我们建议正在进行的研究可纳入 GMI 作为评估 TRKi 疗效的次要目标。GMI 的一个局限是它排除一线治疗后死亡的患者,因为这些危重患者被排除在分析之外。另一个限制是可进行分析的非 HGG 患者样本量小,限制了将这些观察结果推广到其他组织学的能力。
虽然我们通过电子邮件广泛地联系了提供者来识别潜在患者,但我们可能从之前通过其他临床研究建立合作的中心那里收集了更多回复。两位主要作者参与了拉罗替尼临床试验,以及该队列年龄较低(拉罗替尼是唯一经 FDA 批准用于 12 岁以下患者的 TRK 抑制剂),可能解释了为什么我们收集的拉罗替尼治疗患者多于其他 TRKi。本研究的另一个潜在局限是仅包括当地确认 NTRK 融合的患者。这可能偏向于结局较差的患者,因为难以治疗或疾病复发的患者可能更频繁地进行检测。
最后,尽管我们报告了最大的 NTRK 融合 CNS 肿瘤患者队列,但本研究仅包括少量胚胎性肿瘤甚至 LGG 患者。我们计划继续收集数据并增加患者数量,但迫切需要未来的前瞻性临床试验来解决我们数据分析的局限性。
总之,本研究描述了大队列 NTRK 融合 CNS 肿瘤患者。我们发现低龄和低级别组织学与结局较优相关。TRKi 似乎改善了一部分患者的肿瘤控制,尤其是儿童 HGG。需要更多的前瞻性研究和临床试验来改善 NTRK 融合 CNS 肿瘤患者的管理。化疗和放疗等标准治疗可以与初始 TRKi 治疗进行比较。先微创手术后 TRKi 治疗和二次探查手术也可以在临床试验中进行研究。
参考文献:
Lamoureux AA, Fisher MJ, Lemelle L, Pfaff E, Amir-Yazdani P, Kramm C, De Wilde B, Kazanowska B, Hutter C, Pfister SM, Sturm D, Jones DTW, Orbach D, Pierron G, Raskin S, Drilon A, Diamond EL, Harada G, Zapotocky M, Zamecnik J, Krskova L, Ellezam B, Weil AG, Venne D, Barritault M, Leblond P, Coltin H, Hammad R, Tabori U, Hawkins C, Hansford JR, Meyran D, Erker C, McFadden K, Sato M, Gottardo NG, Dholaria H, Nørøxe DS, Goto H, Ziegler DS, Lin FY, Parsons DW, Lindsay H, Wong TT, Liu YL, Wu KS, Franson AT, Hwang E, Aguilar-Bonilla A, Cheng S, Cacciotti C, Massimino M, Schiavello E, Wood P, Hoffman LM, Cappellano A, Lassaletta A, Van Damme A, Llort A, Gerber NU, Spalato Ceruso M, Bendel AE, Skrypek M, Hamideh D, Mushtaq N, Walter A, Jabado N, Alsahlawi A, Farmer JP, Coleman C, Mueller S, Mazewski C, Aguilera D, Robison NJ, O'Halloran K, Abbou S, Berlanga P, Geoerger B, Øra I, Moertel CL, Razis ED, Vernadou A, Ducray F, Bronnimann C, Seizeur R, Clarke M, Resnick AC, Alves M, Jones C, Doz F, Laetsch TW, Perreault S. Clinical characteristics and outcome of central nervous system tumors harboring NTRK gene fusions. Clin Cancer Res. 2024 Dec 3. doi: 10.1158/1078-0432.CCR-24-0581. Epub ahead of print. PMID: 39625867.



