IVD前沿丨可识别任何核酸形式靶标的新型Cas核酸酶
时间:2024-12-16 14:01:51 热度:37.1℃ 作者:网络
CRISPR/Cas系统,是原核生物的一种获得性免疫系统,用于抵抗存在于噬菌体或质粒的外源遗传元件的入侵。这些CRISPR-Cas系统依赖于核酸酶使用crRNA作为引导,以及一个非自身序列进行目标识别,并切割目标核酸或广泛RNA或DNA降解。Cas核酸酶在核酸靶向方面的能力使其在许多应用中被用于基因组编辑和诊断。Cas12a核酸酶可以利用crRNA进行多路复用,并产生更少的脱靶。并且,激活的Cas12a具有旁切活性(collateral activity),已被用于信号扩增作为基于CRISPR的分子诊断的一部分。尽管具有潜力,但Cas12a的效率也低于其他Cas核酸酶。
近日,杂志Nature biotechnology上发表了一篇题为“A resurrected ancestor of Cas12a expands target access and substrate recognition for nucleic acid editing and detection”的文章。作者设计了一个功能完整的Cas核酸酶ReChb,在3个细胞系、7个基因和16个靶点上产生了PAM灵活编辑,优于自然和工程Cas12a核酸酶enAsCas12a,可以靶向和旁切RNA、ssDNA和dsDNA。因此,ReChb为从基因治疗到分子诊断的众多基于CRISPR的生物技术应用提供了一个独特和通用的工具。

图片来源:Nature biotechnology
主要内容
应用Cas12a核酸酶的ASR生成ReChb
作者采用了一种基于祖先序列重建(ASR)的方法,设计了一个功能完整的复活Cas核酸酶,产生的Cas12a祖先,称之为ReChb。ReChb氨基酸序列与Francisella novicida Cas12a(FnCas12a)的同源性为53%。ReChb与其他门的代表性序列进行比对显示,REC1结构域存在显著差异(下图b)。
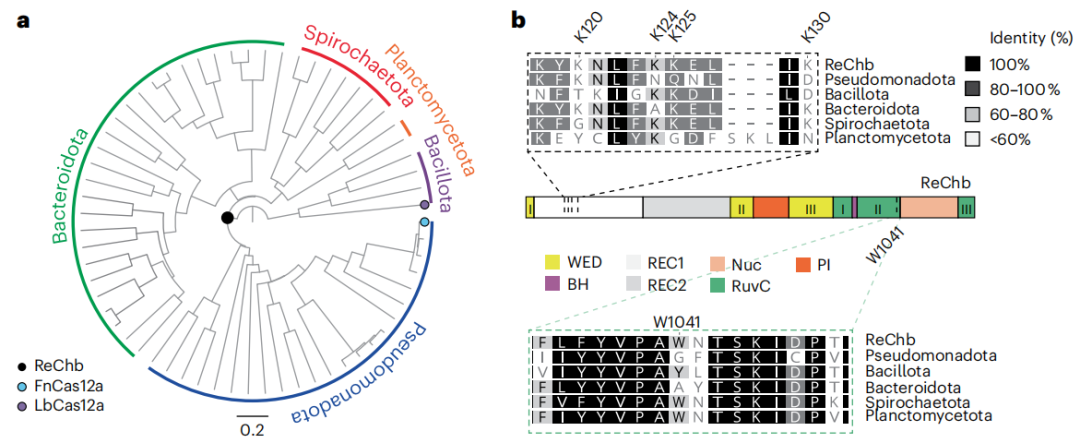
应用Cas12a核酸酶的ASR生成ReChb。
图片来源:Nature biotechnology
ReChb在人类细胞中表现出强大的PAM灵活编辑
作者应用体外切割实验探讨了ReChb的PAM要求。结果显示,在-2和-3位置对C/T有适度的偏好,但没有明显的要求。作者评估了ReChb在人类细胞中的靶向灵活性,并与工程Cas12a变体enAsCas12a进行了比较。结果显示,针对4个人类基因(DNMT1、CFTR、FANCF和RUNX)的15个位点中,ReChb在两个具有典型PAM的目标位点(范围30-37%),以及两个具有T/C-rich PAM的目标位点(范围22-29%),也在不能被enAsCas12有效识别的位点,如5‘-TCGG-3(40%),5-TATT-3(38%),5’-AGTT-3(17%)或5‘-TGTT-3(17%)产生了有效编辑(图d,e)。这些数据表明,ReChb能够对非典型PAM的位点进行稳健灵活编辑,在头对头的比较中优于enAsCas12a。
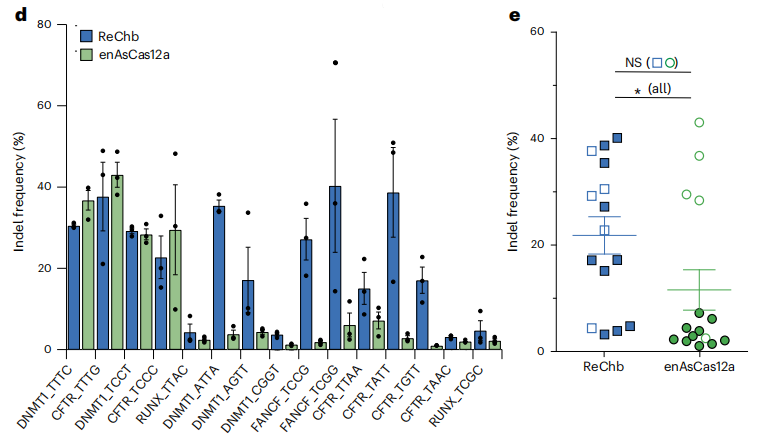
ReChb在人类细胞中具有广泛的PAM识别活性。
图片来源:Nature biotechnology
ReChb接受dsDNA、ssDNA和RNA以及改变的crRNA
作者探索了ReChb的识别靶标和底物。结果发现ReChb在体外条件下切割了互补的dsDNA(下图a)、ssDNA(下图b)和ssRNA(下图c)靶点,说明ReChb可以被dsDNA、ssDNA或ssRNA激活。接下来研究了旁切活性。对于所有激活底物,ReChb降解了非靶标dsDNA、ssDNA和ssRNA。ReChb所表现出的灵活的靶向特性超出了在现代生物体中发现的任何具有个体特征的Cas核酸酶。
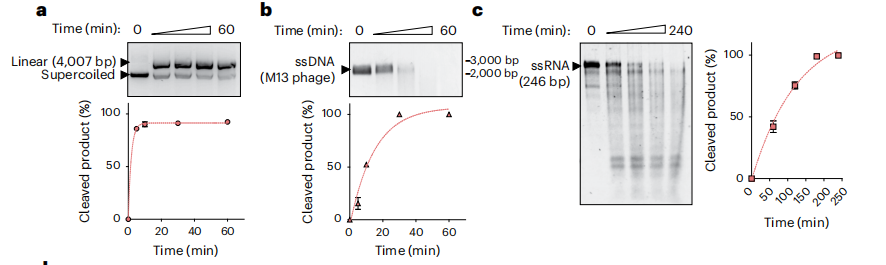
ReChb的体外活性研究。图片来源:Nature biotechnology
ReChb作为一种分子诊断的工具
基于观察到的ReChb的侧支裂解活性,作者评估了ReChb作为一种分子诊断的工具。将ReChb-crRNA RNP复合物与dsDNA、ssDNA或ssRNA靶标以及短ssRNA(图h)和ssDNA(图i)信标孵育(图g)。与没有靶标相比,所有靶标和分子信标的组合都导致荧光增加。相比之下,FnCas12a-crRNA RNP只有在将dsDNA或ssDNA靶标与ssDNA分子信标结合时,才会产生增加的荧光。因此,ReChb可以扩展现有的基于CRISPR的分子诊断能力,通过一个单一的核酸酶,能够接受不同类型的核酸生物标记物和分子信标。
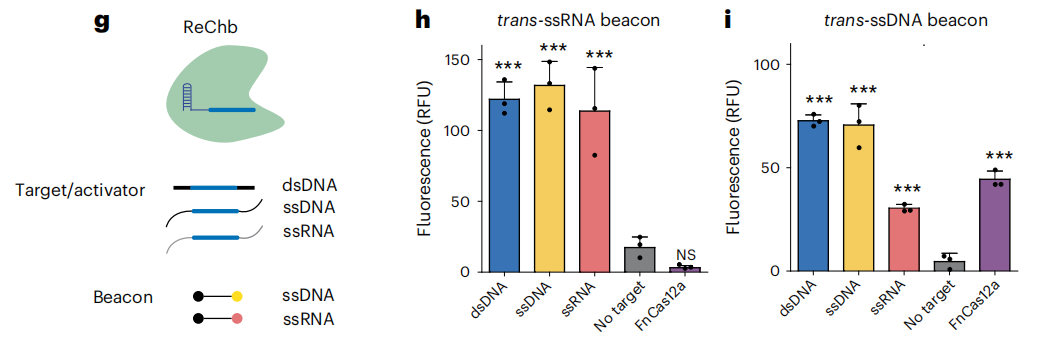
ReChb作为一种分子诊断的工具。
图片来源:Nature biotechnology
ReChb在分子诊断方面的特异性和灵活性
传统的CRISPR-Cas诊断系统受到靶点序列之前PAM序列的限制,影响了对任何靶点的普遍识别。作者通过结合ReChb的旁切活性和PAM柔性识别,尝试克服该技术的主要局限性。作者比较了ReChb与野生型LbCas12a旁切活性(图a)。结果显示,ReChb具有类似于LbCas12a的催化特性,一种基于CRISPR诊断的主要核酸酶,同时也提供PAM的灵活性和室温下可测量的活性,非常适合于即时分子诊断。
作者将ReChb应用于一个需要dsDNA识别和PAM灵活性的应用中:检测16S rDNA短(21-bp)可变区域(图e)。通过应用这种方法,可以使用通用引物退火到16S rDNA的保守区域来扩增目标区域,从而避免了与多路预扩增相关的困难。作者设计了4种不同的crRNA,与4种细菌16S rDNA的4个可变区杂交。该区域传统的基于cas12a的诊断方法无法识别。作者评估了每个16S dsDNA片段和每个crRNA的侧支切割活性。结果发现,ReChb仅在dsDNA 16S片段与crRNA序列匹配时才会触发荧光释放(图f)。这些结果表明了ReChb在分子诊断方面的特异性和灵活性。
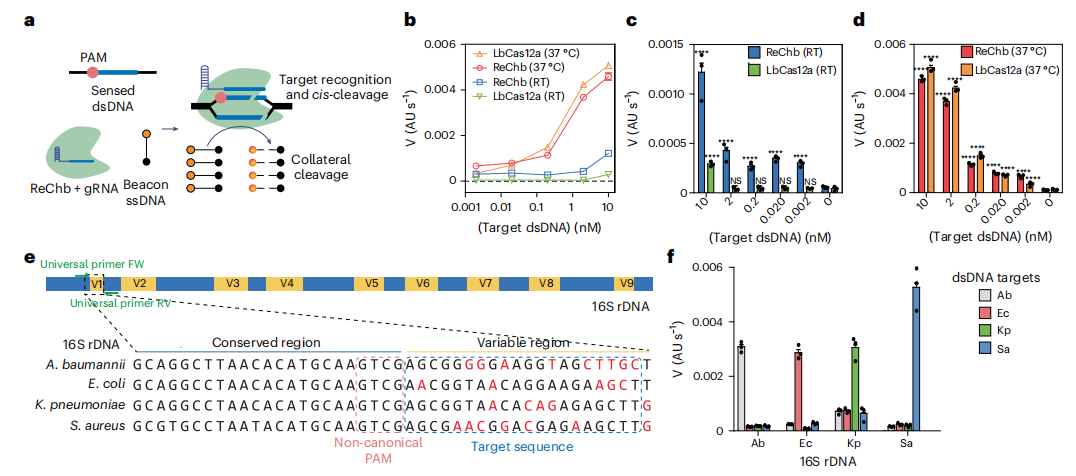
ReChb作为无PAM的dsDNA靶标识别的分子诊断工具。
图片来源:Nature biotechnology
总结与讨论
使用计算方法的蛋白质设计技术提供了一个机会来改进甚至设计具有天然酶中没有的特性的催化剂。作者采用了一种基于祖先序列重建(ASR)的方法,设计了一个功能完整的复活Cas核酸酶,ReChb。ReChb可以识别任何核酸形式作为靶标,并能够进行特异性或非特异性的顺式/反式切割。此外,作者证明了ReChb的PAM灵活识别能力可以克服基于cas12的诊断的主要限制之一——在不受PAM限制的情况下识别dsDNA靶点。因此,ReChb为从基因治疗到分子诊断的众多基于CRISPR的生物技术应用提供了一个独特和通用的工具。


