好文推荐 | 不同运动亚型帕金森病自主神经功能障碍及其与生活质量的关系临床研究
时间:2024-12-14 19:01:08 热度:37.1℃ 作者:网络
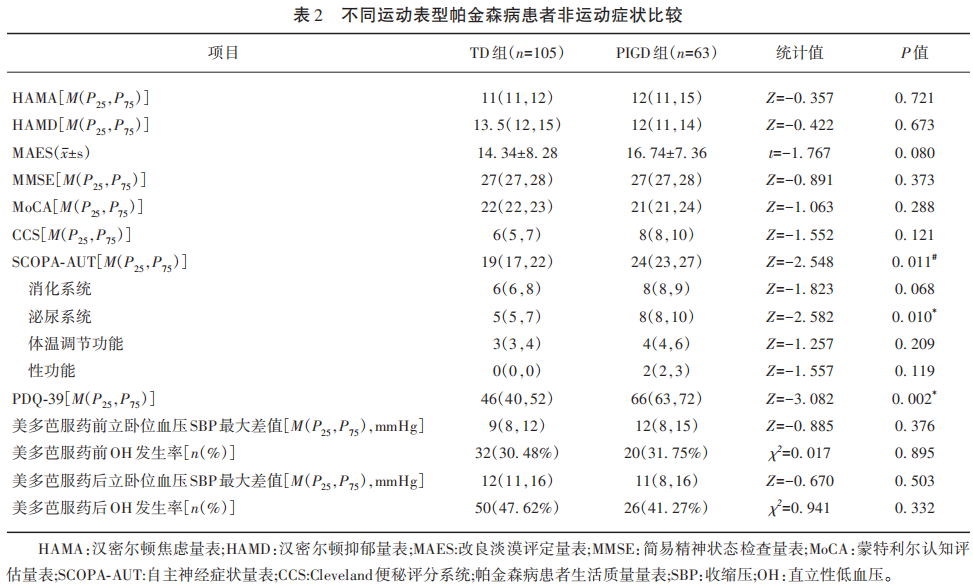
摘要 目的 本研究旨在探索帕金森病(PD)不同运动亚型的患者在自主神经功能症状的特征,以及不同运动亚型帕金森病患者自主神经功能损害对生活质量的影响。方法 对所有入组患者记录基本信息,运动症状和非运动症状评分。根据运动功能评分中的震颤(TD)和姿势步态异常(PIGD)评分进行亚型分类。比较TD型和PIGD型患者的运动症状、非运动症状,尤其是自主神经症状,并分析不同运动分型自主神经功能症状与生活质量之间的关系,相关性分析采用Pearson或Spearman相关分析法。结果 共入组TD组105例(57.7%),PIGD组63例(34.6%),一般情况和运动症状无明显差异。分别比较TD组与PIGD组间焦虑、抑郁、淡漠、认知、便秘、服药前后立卧位收缩压血压差值和直立性低血压发生率两组间无明显差异。自主神经功能总分PIGD组(中位数24)明显高于TD组(中位数19)。生活质量评分PIGD组中位数66分,TD组中位数46分,PIGD组明显较TD组生活质量差。PIGD组与TD组帕金森病患者生活质量与自主神经功能症状呈正相关(PIGD组R2=0.209,P≤0.001;TD组R2=0.166,P≤0.001)。TD组生活质量与便秘相关(r=0.313,P=0.002)且与美多芭服药前立卧位血压收缩压最大差值相关(r=0.252,P=0.009)。结论 PIGD型较TD型PD患者自主神经功能症状严重、生活质量差。两种运动亚型的PD患者均存在自主神经功能损伤越严重,生活质量越差。TD型患者生活质量还与便秘和美多芭服药前立卧位血压收缩压最大差值相关。 帕金森病(Parkinson disease,PD)是常见的神经系统变性疾病,以运动迟缓、静止性震颤、肌强直等运动症状为主要表现,此外通常伴自主神经功能障碍、认知功能障碍、睡眠障碍、抑郁、焦虑、淡漠、便秘、直立性低血压等非运动症状,严重影响生活质量。其中,自主神经功能障碍是帕金森病常见的致残性非运动症状,表现为体温调节功能下降、尿失禁、尿潴留、便秘、心血管功能异常等。PD运动障碍的异质性逐渐得到研究者们的重视,主要分为震颤型(tremor-dominant,TD)和姿势步态异常型(postural instability and gait difficulty,PIGD),不同的运动表型具有不同的临床特征及预后。既往研究显示,相对TD型患者,PIGD患者非运动症状更重,日常生活活动能力更差,更多的睡眠障碍、自主神经功能障碍及情绪问题,预后较差。然而,目前对于不同运动分型PD患者的自主神经功能研究较少。本研究对PD的非运动症状特别是自主神经功能进行评估,并进一步分析PD不同运动亚型之间运动并发症、认知功能、抑郁/焦虑情绪、情感淡漠、便秘、卧立位血压差值等非运动症状的差异性,从而探讨帕金森病生活质量与PD不同运动亚型自主神经功能症状之间的关系,以期为PD患者提供更精准的病情评估,在此基础上制定更合理的治疗方案,为临床早期干预提供依据。 1 资料与方法 1.1 研究对象 连续观察2018年1月—2019年6月首都医科大学附属北京天坛医院神经病学中心运动障碍性疾病科收治的PD患者182例。 1.2 入排标准 入组标准:(1)年龄⫺18岁,且≤80岁;(2)根据国际帕金森病和运动障碍学会2015年帕金森病临床诊断标准,符合临床确诊帕金森病;(3)可配合各项量表评估。 排除标准:(1)排除继发性帕金森综合征、帕金森叠加征或多巴反应肌张力障碍,排除入组前即诊断患有肾功能不全等可能造成自主神经系统损害的基础疾病。(2)排除脱水、急性失血、药物(如降压药和抗抑郁药)、心排血量减少(如缩窄性心包炎、心肌病和主动脉瓣狭窄)、内分泌疾病(如肾上腺功能不全和嗜铬细胞瘤)和血管过度扩张(如类癌综合征)。 1.3 运动症状及非运动症状的评估 详细记录临床信息,内容包括性别、发病年龄、病程、体重指数等。采集血液样本,包括血脂、同型半胱氨酸等。 所有研究对象均由2名运动障碍专科医生测评多项运动功能及非运动功能量表。量表包括如下。 (1)运动功能:采用运动障碍协会统一帕金森病评定量表Ⅲ(Movement Disorder Svcienty-Unified Parkinson Disease Rating Scale III,MDS-UPDRS Ⅲ)评价运动功能。运动并发症,包括剂末现象、异动和冲动强迫现象。剂末现象问卷(Wearing-off Questionnaire-19,WOQ-19)有1项或以上症状的出现并在下次服药后得到改善或消失,即评定为存在剂末现象。MDS-UPDRS第Ⅳ部分的4.1≥1分考虑存在异动。帕金森病冲动与强迫控制障碍问卷(Questionnaire for Impulsive Compulsive Disorders,QUIP)如果患者或其家属对上述任1项内容回答“是”,则诊断为相应的冲动控制障碍。 (2)生活质量评估:采用39项PD患者生活质量表(Quality of Life Questionnaire for PD Patients 39,PDQ-39)。评估患者日常生活质量,包含行动能力、日常生活、情感体会、疾病屈辱感、社会支持、认知、交流、躯体不适感8个维度39项,每项发生频率以0~4分表示,总分156分,评分越高表示生活质量越差。 (3)自主神经功能评估:采用自主神经症状量表(The Scale For Outcomes in PD For Autonomic Symptoms,SCOPA-AUT)评定自主神经症状严重程度,该量表包含胃肠道(21分)、泌尿(18分)、心血管(9分)、体温调节(12分)、瞳孔调节(3分)、性功能(6分),6个系统共23个项目,各项目评分以0~3分表示频率,0分表示“从不”;1分表示“有时”;2分表示“时常”;3分表示“频繁”,总分69分,评分越高表示自主神经功能障碍越严重。Cleveland便秘评分系统(Cleveland Constipation Scale,CCS)超过15分考虑便秘,分值越高,便秘程度越严重。 (4)血压测量:卧立位试验:在床边仰卧位休息5 min后,记录他们的血压和心率(HR),随后在床旁站立,站立即刻和在1 min、2 min、3 min和5 min时记录他们的血压和心率,记录站立时最低的血压值。采集时间为急性左旋多巴冲击试验服药前的长期基础测评,服药后1 h、2 h、3 h后分别进行卧立位试验。使用自动血压计(Omron HEM-7312,Omron Healthcare Co.Ltd.,Kyoto,Japan)在左臂与心脏齐平位置进行血压测量。每条血压记录都要测量2次,并取其平均值来评估血压值。直立性低血压诊断:由仰卧位变为直立位后3 min内收缩压持续下降至少20 mmHg或舒张压持续下降10 mmHg。 (5)认知功能评估:简易精神状态检查量表(Mini-mental State Examination,MMSE)总分30分,评分越高表明认知功能越好,文盲≤17分,小学≤20分,初中≤24分为痴呆。蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)满分30分,总分≤26分表明存在认知功能障碍,评分越低表明认知功能障碍越严重。 (6)情绪评估:汉密尔顿焦虑量表(Hamilton Depression Scale,HAMA)14项版本、汉密尔顿抑郁量表(Hamilton Depression Scale,HAMD)、改良淡漠评定量表(Modified Apathy Evaluation Scale,MAES)。 1.4 分组 根据MDS-UPDRSⅢ运动功能评分中的TD/PIGD评分进行亚型分类,MDS-UPDRSⅢ中的2.10、3.15a、3.15b、3.16a、3.16b、3.17a、3.17b、3.17c、3.17d、3.17e、3.18为震颤项目,全部相加取平均值后除以轴性项目2.12、2.13、3.10、3.11和3.12之和所取的平均值。比值≥1.15的患者归类为震颤亚型(tremor dominant,TD)组,比值≤0.90的患者归为(postural instability gait disorder,PIGD)组,比值在0.90~1.1之间患者归类为混合型(indeterminate,IT)组。 1.5 统计学分析 应用SPSS 26.0统计软件进行数据分析。符合正态分布的计量资料用(x±s)表示,采用两独立样本t检验。不符合正态分布计量资料用[M(P25,P75)]表示,采用两成组资料秩和检验。性别、异动、剂末现象、QUIP行χ2检验。连续数据相关性分析采用Pearson相关分析法,非参数相关性分析采用Spearman相关分析法,以P<0.05为差异有统计学意义。 2 结 果 2.1 一般资料 共入组PD患者182例,其中TD组105例(57.7%),PIGD组63例(34.6%),IT组14例(7.7%)。平均年龄(62.20±10.01)岁、31~79岁,平均病程(6.90±4.60)年、1~30年。TD组和PIGD组患者在年龄、性别、生活习惯、病程、左旋多巴等效剂量、疾病严重程度、美多巴冲击试验改善率、运动并发症等无明显差异无统计学意义(见表1)。 2.2 不同运动分型非运动症状比较 分别比较TD组与PIGD组间各项非运动症状量表评分,焦虑、抑郁、淡漠、认知、便秘、服药前后立卧位收缩压血压差值、服药前后直立性低血压(orthostatic hypotension,OH)发生率两组间无明显差异。自主神经功能总分PIGD组(中位数24)明显高于TD组(中位数19);泌尿系统自主神经功能评分PIGD组(中位数8)明显高于TD组(中位数5)。生活质量评分PIGD组中位数66分,TD组中位数46分,PIGD组明显较TD组生活质量差(见表2)。 2.3 不同运动分型帕金森病患者的日常生活质量与自主神经症状的关系 对不同运动分型帕金森病患者的帕金森病日常生活质量问卷调查评分与自主神经症状量表评分做散点图(见图1),并对PD日常生活质量问卷调查评分分别于总体PD患者自主神经功能症状及其亚项、TD组PD患者自主神经功能症状及其亚项、PIGD组帕金森病患者自主神经功能症状及其亚项做相关分析(见表3)。PIGD组与TD组PD患者生活质量与自主神经功能症状呈正相关(PIGD组R2=0.209,P≤0.001;TD组R2=0.166,P≤0.001),自主神经功能损伤越严重,生活质量越差。TD组生活质量与便秘相关(r=0.313,P=0.002),便秘越严重生活质量越差;PIGD组生活质量与便秘无明显相关。TD组生活质量与美多芭服药前立卧位血压SBP最大差值相关(r=0.252,P=0.009);PIGD组生活质量与美多芭服药前立卧位血压SBP最大差值无明显相关。PIGD组与TD组帕金森病患者生活质量与美多芭服药后立卧位血压SBP最大差值无明显相关。 3 讨 论 PD是一种异质性神经变性疾病,PIGD型和TD型帕金森病患者在运动症状、病情进展速度以及对多巴胺能药物治疗的反应上存在着明显差异。在既往研究中发现,PIGD型和TD型帕金森病患者在非运动症状上也存在明显差异,PIGD型患者的非运动症状在症状个数和严重程度上要明显高于TD型患者。PIGD型患者睡眠、疲劳和泌尿系统症状(尿急的发生率)、认知等较TD型患者严重。对自主神经功能的损害在PIGD型和TD型之间的差异研究较少。 本研究发现在病程、左旋多巴等效剂量、疾病严重程度、运动并发症、情绪、认知无明显差异的情况下,PIGD患者的自主神经症状量表、帕金森病患者生活质量量表调查评分均高于TD患者,表明PIGD患者的自主神经功能损害更严重,生活质量更差。本研究还发现,PIGD型和TD型帕金森病患者的生活质量与自主神经症状呈正相关,自主神经功能损害越严重生活质量越差,其中消化系统、泌尿系统、心血管系统的自主神经功能症状越重PIGD型和TD型帕金森病患者生活质量越差,体温调节功能越差TD型帕金森病患者生活质量越差。PD不仅累及黑质纹状体系统造成运动迟缓、强直、震颤、姿势步态异常等运动系统障碍,近年的研究表明PD的病变范围非常广泛,如丘脑下部、迷走神经背核、交感神经节、肾上腺髓质等也受影响,可伴有自主神经功能、情绪、认知等方面的改变,甚至非运动症状成为主要的临床表现。特别是蓝斑、下丘脑背部、迷走神经背核这些多巴胺能神经元的损害,可能导致自主神经功能障碍。在中枢神经系统的中缝核、巨细胞网状核、蓝斑等部位和周围自主神经通路中都发现了α-突触核蛋白,PD可能是直接导致自主神经功能障碍的原因。以往认为自主神经损害在PD患者中出现较晚,是与多系统萎缩鉴别的一个重要标志。但近年来越来越多研究发现自主神经系统障碍在帕金森病患者中非常常见,其发生率为14%~80%,并可以出现在PD疾病的早期,表现为头晕、出汗、心悸、便秘、尿频、尿急、性功能减退等。既往研究显示,71%的PD患者在早期即可存在至少1种自主神经症状,并随着疾病的进展逐渐加重,严重影响患者的生活质量,并可影响PD患者的寿命。 本研究还发现,TD型患者便秘和服药前直立性低血压越严重生活质量越差。我们在前期工作中发现直立性低血压是PD患者的常见自主神经受损表现,服用左旋多巴药物后更易发生,且PD患者中合并卧位高血压和直立性低血压的发生率高,卧位高血压和便秘是PD患者直立性低血压的高危因素。慢性便秘是PD患者最常见的自主神经功能紊乱的胃肠道症状,是目前公认的PD最突出的前驱表现,70%~80%的PD患者患有此病。PD便秘的生理基础是肠蠕动减慢,而且是许多抗帕金森病药物的副作用,除便秘外还可导致巨结肠、肠扭转、结肠穿孔等,并随着疾病进展而加重。 参考文献 [1]Huang X,Ng SYE,Chia NSY,et al. Non-motor symptoms in early Parkinson’s disease with different motor subtypes and their associations with quality of life[J]. Eur J Neurol,2019,26(3):400-406. [2]Wang JY,Wang MY,Liu RP,et al. Association analyses of autonomic dysfunction and sympathetic skin response in motor subtypes of Parkinson’s disease[J]. Front Neurol,2020,11:577128. [3]Aleksovski D,Miljkovic D,Bravi D,et al. Disease progression in parkinson subtypes:the PPMI dataset[J]. Neurol Sci,2018,39(11):1971-1976. [4]van der Heeden JF,Marinus J,Martinez-Martin P,et al. Postural instability and gait are associated with severity and prognosis of Parkinson disease[J]. Neurology,2016,86(24):2243-2250. [5]Schrag A. Testing the MDS clinical diagnostic criteria for Parkinson’s disease[J]. Mov Disord,2018,33(10):1518-1520. [6]Espay AJ,LeWitt PA,Hauser RA,et al. Neurogenic orthostatic hypotension and supine hypertension in Parkinson’s disease and related synucleinopathies:prioritisation of treatment targets[J]. Lancet Neurol,2016,15(9):954-966. [7]Stebbins GT,Goetz CG,Burn DJ,et al. How to identify tremor dominant and postural instability/gait difficulty groups with the movement disorder society unified Parkinson’s disease rating scale:comparison with the unified Parkinson’s disease rating scale[J]. Mov Disord,2013,28(5):668-670. [8]Bloem BR,Okun MS,Klein C. Parkinson’s disease[J]. Lancet,2021,397(10291):2284-2303. [9]仲玲玲,宋亚頎,曹化,等. 不同运动分型帕金森病患者的非运动症状分析[J]. 中华全科医师杂志,2018,17(1):56-59. [10]Kamath T,Macosko EZ. Insights into neurodegeneration in Parkinson’s disease from single-cell and spatial genomics[J]. Mov Disord,2023,38(4):518-525. [11]Chen Z,Li G,Liu J. Autonomic dysfunction in Parkinson’s disease:implications for pathophysiology,diagnosis,and treatment[J]. Neurobiol Dis,2020,134:104700. [12]Estaun-Panzano J,Arotcarena ML,Bezard E. Monitoring α-synuclein aggregation[J]. Neurobiol Dis,2023,176:105966. [13]Wichmann T. Changing views of the pathophysiology of Parkinsonism[J]. Mov Disord,2019,34(8):1130-1143. [14]Hiorth YH,Pedersen KF,Dalen I,et al. Orthostatic hypotension in parkinson disease:a 7-year prospective population-based study[J]. Neurology,2019,93(16):e1526-e1534. [15]张哲,陈生弟. 帕金森病自主神经功能障碍研究进展[J]. 中国现代神经疾病杂志,2019,19(5):367-373. [16]Stanković I,Petrović I,Pekmezović T,et al. Longitudinal assessment of autonomic dysfunction in early Parkinson’s disease[J]. Parkinsonism Relat Disord,2019,66:74-79. [17]Pfeiffer RF. Autonomic dysfunction in Parkinson’s disease[J]. Neurotherapeutics,2020,17(4):1464-1479. [18]Kim JB,Kim BJ,Koh SB,et al. Autonomic dysfunction according to disease progression in Parkinson’s disease[J]. Parkinsonism Relat Disord,2014,20(3):303-307. [19]De Pablo-Fernandez E,Tur C,Revesz T,et al. Association of autonomic dysfunction with disease progression and survival in parkinson disease[J]. JAMA Neurol,2017,74(8):970-976. [20]柳竹,苏东宁,刘亘梁,等. 早发型帕金森病患者直立性低血压的危险因素[J]. 神经损伤与功能重建,2022,17(6):328-332. [21]柳竹,苏东宁,刘亘梁,等. 帕金森病合并直立性低血压及卧位高血压的临床特征分析[J]. 神经损伤与功能重建,2022,17(8):439-443,466. [22]Liu Z,Su D,Zhou J,et al. Acute effect of levodopa on orthostatic hypotension and its association with motor responsiveness in Parkinson’s disease:results of acute levodopa challenge test[J]. Parkinsonism Relat Disord,2023,115:105860. [23]Camilleri M. Gastrointestinal motility disorders in neurologic disease[J]. J Clin Invest,2021,131(4):e143771.