【AJH】霍奇金淋巴瘤的诊断、风险分层和治疗(2025更新)
时间:2024-09-11 11:01:13 热度:37.1℃ 作者:网络
霍奇金淋巴瘤
霍奇金淋巴瘤(Hodgkin lymphoma,HL)是一种少见的累及淋巴结及淋巴系统的恶性肿瘤,可分为结节性淋巴细胞为主型HL(NLPHL)和经典型HL(cHL)。cHL约占HL的90%,特征为肿瘤细胞-里德-斯特恩伯格(Hodgkin Reed-Sternberg,HRS)细胞与异质性非肿瘤炎性细胞混合存在,HRS细胞CD30高表达且下游NF-kappaB通路持续性激活,为青年人中最常见的恶性肿瘤之一。cHL可分为4种组织学亚型,即结节硬化型、富于淋巴细胞型、混合细胞型和淋巴细胞消减型。
梅奥诊所Stephen M Ansell教授在《American Journal of Hematology》的ANNUAL CLINICAL UPDATES IN HEMATOLOGICAL MALIGNANCIES项目定期发表霍奇金淋巴瘤的诊疗综述,近日发表了2025版更新,现整理全文供参考。

1.疾病概述
霍奇金淋巴瘤占所有淋巴瘤的10%左右,呈双峰分布,在年轻成人和≥55岁患者中发病率较高。HL无明确定义的风险因素,病因尚不清楚,与 HL 相关的因素包括家族因素、病毒暴露和免疫抑制。HL患者的同性别兄弟姐妹发生疾病的风险高10倍,HL患者的同卵双胞胎发生 HL 的风险与异卵双胞胎兄弟姐妹相比也显著增加。尽管这些家族因素可能提示HL的遗传原因,但研究表明异常免疫对感染的反应也可能在 HL 的发病机制中起一定作用。流行病学和血清学研究表明,HL病因中存在Epstein–Barr病毒 (EBV),在 HL 患者的肿瘤标本中检测到 EBV 基因组。但其他儿童感染性疾病(包括水痘、麻疹、腮腺炎、风疹和百日咳)与 HL 风险呈负相关,可能具有保护性。HL还与HIV感染相关,HIV 感染患者的 HL 风险显著高于一般人群。总体而言,免疫抑制患者(包括 HIV 阳性患者)的 HL 与诊断时疾病分期较晚、疾病部位不寻常和初始治疗后结局较差相关。
在过去40年中,放疗的进展、联合化疗方案的开发以及抗体药物偶联物和免疫检查点抑制剂的开发显著改善了 HL 患者的治愈率。目前,在所有年龄小于60岁的新诊断患者中,超过80%的患者有可能实现治愈。
2.诊断
大多数 HL 患者诊断表现为膈上淋巴结肿大,常表现为颈部、前纵隔、锁骨上和腋窝淋巴结受累,而腹股沟区受累较少。大约1/3的患者表现为全身症状,包括发热、盗汗和体重减轻;许多患者还表现为慢性瘙痒。虽然该病最常累及临近淋巴结组织,但也可通过直接侵袭或血行播散影响结外组织,最常受累的结外部位为脾、肺、肝和骨髓。
HL 的初步诊断仅应通过活检做出。细针穿刺或粗针活检并不充分,因为淋巴结的结构对准确诊断极其重要。HL是一种独特的恶性肿瘤,因为肿瘤细胞占细胞群的少数,活检不充分可能无法将恶性肿瘤细胞包括在标本中。对于确诊,应在正常反应性淋巴细胞、嗜酸性粒细胞和组织细胞的适当细胞环境中识别恶性 Reed-Sternberg 细胞(滤泡中心 B 细胞来源)。根据WHO血液淋巴组织肿瘤分类,HL由两种不同的亚型组成;更常见的经典型 HL 和罕见的结节性淋巴细胞为主型HL。cHL分为结节硬化型(Nodular sclerosis)、富于淋巴细胞型(lymphocyte-rich)、混合细胞型(mixed cellularity)和淋巴细胞消减型(lymphocyte depletion)。然而,与国际成熟淋巴肿瘤共识分类相关的临床咨询委员会最近认为,基于与cHL的主要生物学和临床差异以及与T细胞/组织细胞丰富的大B细胞淋巴瘤(THRLBCL)的密切关系,有必要对结节性淋巴细胞为主型HL使用新的术语,并引入术语结节性淋巴细胞为主型 B 细胞淋巴瘤 (NLPBL),但这是否会被普遍接受仍有待观察。
2.1.经典型霍奇金淋巴瘤
在特征性反应性细胞背景内存在恶性多核巨大 Reed-Sternberg 细胞是cHL的病理学标志。无痛性淋巴结肿大是cHL 最常见的临床表现,但每种组织学亚型均有其独特的临床表现。结节硬化型是最常见的亚型,更常见于青少年和年轻成人,通常表现为累及颈部、锁骨上和纵隔区域的局部病变。混合细胞型 HL 在儿科以及老年组中更普遍,通常与疾病分期更晚和预后更差相关。淋巴细胞消减型HL 的发生率似乎远低于之前报道,许多病例重新分类为非霍奇金淋巴瘤。该亚型主要发生于老年患者和获得性免疫缺陷综合征患者,患者通常表现为症状性广泛性疾病,无外周淋巴结肿大。形态学方面,富于淋巴细胞型HL 与结节性淋巴细胞为主型HL相似(见下文),但前者的Reed-Sternberg细胞具有与cHL一致的更经典的免疫表型。
既往研究表明Reed-Sternberg 细胞上程序性死亡-1(PD-1) 配体过表达,包括 PD-L1(CD274/B7-H1) 和PD-L2(CD273/B7-DC)。染色体9p24.1的拷贝数变异和基因改变,以及 JAK2 信号传导增加,占 PD-L1 和 PD-L2 过表达的大多数病例。PD-L1/PD-L2改变是HL的典型特征,并导致细胞表面 PD-L1 或 PD-L2 的极高表达,从而保护 Reed-Sternberg 细胞免受 T 细胞介导的杀伤。虽然9p24.1扩增在晚期患者中更常见,并且与接受化疗患者的无进展生存期缩短相关,但Reed-Sternberg 细胞上 PD-L1 表达和MHC II 类阳性是 PD-1 阻断后有利结局的预测因素。
最近对循环肿瘤 DNA 水平的分析揭示了两种不同的cHL 基因组亚型(H1和 H2 cluster),具有特征性的临床和预后相关性,以及不同的转录和免疫特征。H1 cluster肿瘤常见于年轻患者,约占病例的68%,主要由涉及NFkB、JAK/STAT和PI3K信号通路的基因体细胞突变所主导。而H2 cluster肿瘤约占病例的32%,预后较差,其主要特征为各种SCNA事件和TP53和KMT2D突变。
2.2.结节性淋巴细胞为主型霍奇金淋巴瘤
结节性淋巴细胞为主型HL(或最近提出的结节性淋巴细胞为主型 B 细胞淋巴瘤)是与cHL 显著不同的独特临床病理实体。(更多详细信息见结节性淋巴细胞为主型霍奇金淋巴瘤的疾病生物学、风险分层和治疗。)病理学方面,淋巴细胞为主型 HL 缺乏典型的 Reed-Sternberg 细胞,而是以具有被称为淋巴细胞和组织细胞 (L&H) 的折叠分叶核的较大细胞的肿瘤细胞群为特征。与cHL 不同,这些细胞为CD20+,通常为 CD30 阴性。淋巴细胞为主型 HL 更常见于男性,就诊时的全身症状及结外疾病罕见。患者通常表现为局限性淋巴结病变,通常累及颈部区域并保留纵隔。淋巴细胞为主型 HL 的自然史与cHL 的不同之处在于其病程惰性,有晚期复发的趋势。
3.风险分层
准确评估 HL 患者的疾病分期对于选择适当的治疗至关重要。HL患者的分期系统基于受累淋巴结位于膈膜的一侧还是双侧、受累部位的数量、受累部位是否大包块、是否存在临近结外受累或播散性结外病变,以及是否存在典型的全身症状(B症状)。氟脱氧葡萄糖正电子发射断层扫描 (FDG-PET) 已成为 HL 患者分期的重要工具,较其他标准放射学方法可显著增加分期信息。
HL 患者标准治疗治愈的可能性较高,存在潜在长期并发症的风险,因此确定复发风险低或高的患者非常重要,可基于患者预期临床结局给予优化治疗,以避免部分患者的过度治疗和其他患者的治疗不足。早期 HL 患者的预后因素包括存在较大的纵隔肿块、沉降率升高、累及多个淋巴结部位、结外受累、年龄≥50岁或大包块脾脏疾病。
而在晚期 HL 患者中,疾病大包块和其他传统预后变量对结局的预测性较低,因此国际晚期 HL 预后因素项目为这些患者开发了不同的预后评分系统,在多因素分析中确定7个变量可预测患者结局(年龄≥45岁、存在 IV 期疾病、男性、白细胞计数≥15000个细胞/μL、淋巴细胞计数<600个细胞/μL、白蛋白<4.0g/dL和血红蛋白<10.5 g/dL);具有≥5个因素的患者5年无进展率为42%,而无不良预后因素的患者为84%。但一线治疗期间或之后的 FDG-PET 结果可能比上述治疗前风险分层具有更大的预后意义。此外,根据基线 FDG-PET 扫描确定的代谢性肿瘤体积 (MTV) 可改善 HL 患者的风险分层,是一线联合化疗方案反应的预测因素。
对于结节性淋巴细胞为主型HL 患者,已经开发了淋巴细胞为主型国际预后评分 (LP-IPS),年龄≥45岁、III-IV期、血红蛋白<10.5 g/dL和脾脏受累各得1分。LP-IPS增加与无进展生存期 (PFS;HR=1.52) 和总生存期 (OS;HR=2.31) 更差显著相关,并且淋巴瘤特异性死亡 (HR=2.63) 和转化为侵袭性淋巴瘤组织学 (HR=1.41) 的风险也增加。
4.风险适应性初始治疗
决定 HL 患者初始治疗选择的主要因素为疾病的组织学类型(cHL 或结节性淋巴细胞为主型HL)、疾病的解剖学分期(局限期或进展期)、存在不良预后特征、存在全身症状和存在大包块(定义为单个疾病部位直径>10cm)。在治疗期间,FDG-PET扫描在决定按计划完成治疗还是增加或省略治疗成分方面发挥重要作用。中期FDG-PET阴性可通过缩短给予的周期数、省略放疗或将博来霉素从治疗中排除来降低治疗剂量,以避免发生肺毒性。2个治疗周期后中期 FDG-PET 阳性可能需要强化治疗,治疗结束时PET 阳性可能需要在阳性部位增加巩固放疗。任何时间点的PET 阳性也可能需要重复活检以确认或排除持续性疾病。PET 扫描的使用基于研究,显示治疗结束时FDG-PET 阳性的患者复发率显著更高,无论 CT 扫描的结果如何。此外,在治疗早期(2个周期后)进行的 FDG-PET 可预测 HL 患者的 PFS 和OS,并且是比分期、结外病变或其他预后因素更好的结局预测因子。然而,将维布妥昔单抗或免疫检查点抑制剂作为一线联合治疗的临床试验(尤其是晚期疾病患者)主要关注治疗结束时的 FDG-PET 扫描,而未使用中期 FDG-PET 扫描结果调整治疗。
4.1.初始治疗
目前 HL 患者治疗的标准治疗包括不同的治疗方案,分为早期且具有有利预后特征的患者,早期但具有不良预后特征的患者,以及晚期患者。一般而言,大多数早期患者采用联合治疗策略,包括简短疗程联合化疗序贯受累野放疗 (IFRT) ,而晚期患者则接受更长疗程的化疗而不进行放疗。然而,包括维布妥昔单抗和抗 PD-1 抗体在内的新药目前正在纳入标准联合治疗,允许早期患者省略IFRT,以及晚期患者降低化疗剂量。
4.1.1.早期预后良好HL
在过去几十年中,早期HL(I-IIA期)的治疗策略发生了显著变化。最初延伸野放疗是标准治疗,但由于认识到高复发率和显著的长期并发症,不再使用累及邻近淋巴结区域的延伸野放疗。对接受次全淋巴结放疗联合或不联合 ABVD 化疗(多柔比星、博来霉素、长春碱、达卡巴嗪)的患者与接受单独 ABVD 的患者进行随机比较发现,接受次全淋巴结放疗的患者的总生存期较差,并且因非HL原因死亡的发生率较高。因此,对于预后良好的早期疾病,控制隐匿性病变的短期化疗联合仅限于受累淋巴结区域的 IFRT 是目前的标准实践。大多数工作组给予2-4个周期的联合化疗,随后约20-35 Gy的IFRT。该方案起源于一项四臂研究,将具有预后良好因素的早期 HL 患者随机分配至2或4个周期的 ABVD 化疗和20或 30 Gy IFRT;4组之间的治疗反应、PFS和 OS 无差异。因此,ABVD治疗2个周期后 20Gy IFRT 是目前早期预后良好(无高危特征)HL的标准治疗。
4.1.2.早期预后不良HL
一般认为,I期和 II 期患者如果出现不良风险因素,应接受化疗联合放疗,但最佳化疗周期数及最佳化疗方案、放疗剂量及照射野大小仍有争议。该组患者通常包括有巨大纵隔包块或结外病变的患者,通常接受4个周期的联合化疗和IFRT。这是基于一项大型临床试验,将具有良预后特征的 I/IIA 期 HL 患者随机分配至4个周期 ABVD 组或基线剂量的BEACOPP(博来霉素、依托泊苷、多柔比星、环磷酰胺、长春新碱、丙卡巴肼和泼尼松)持续4个周期联合 20Gy 或30Gy IFRT。如果在 ABVD 中使用 20 Gy 而非30 Gy,则无治疗失败的情况更差;但当与 BEACOPP 一起使用时,20Gy 和 30Gy 之间结局相似。结论是4个周期ABVD 联合30Gy IFRT 是这些患者的标准治疗。随后的一项研究着眼于加强该患者组中使用的化疗,早期预后不良HL 患者接受4个周期的 ABVD 或2个周期的递增剂量 BEACOPP +2个周期的ABVD;所有患者均接受30Gy IFRT。结果无治疗失败有利于积极化疗组(10年时差异为5.6%),但总生存期无差异;治疗相关死亡率或继发恶性肿瘤也无差异。
后续研究旨在确定包括新药(如维布妥昔单抗和 PD-1 抑制剂)是否可以维持疗效并降低潜在毒性,新药可以首先给药、同时给药或作为巩固治疗。结果表明这些联合治疗策略是安全的,可提供极佳的疾病控制,目前正在将这些新型联合治疗与标准方案进行比较(见表1)。
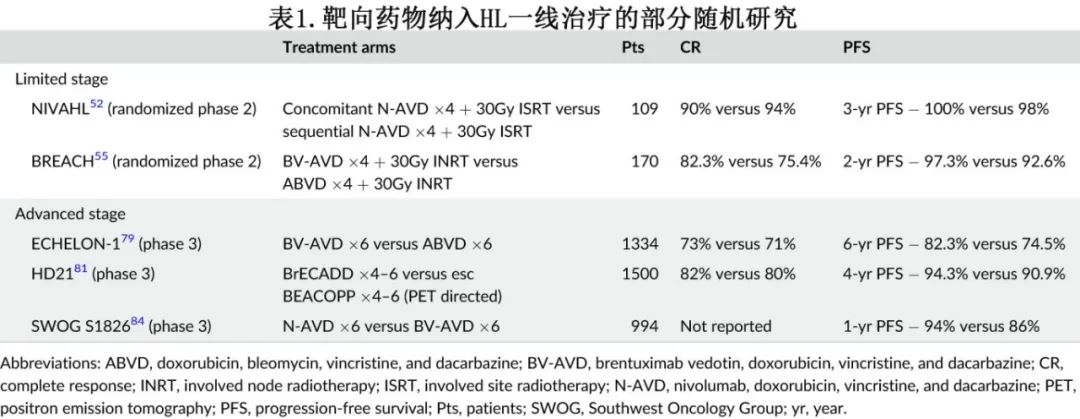
例如,随机 II 期 BREACH 研究在既往未经治疗的早期预后不良HL患者中比较维布妥昔单抗联合多柔比星、长春碱和达卡巴嗪 (BV-AVD) 与标准ABVD +30Gy受累淋巴结放疗 (INRT)。该170例患者研究的主要终点为两个周期后 FDG-PET 阴性的患者百分比,结果达到主要终点,BV-AVD组82.3%的患者为 PET 阴性,而 ABVD 组为75.4%;2年 PFS 分别为97.3%和92.6%。同样,随机 II 期 NIVAHL 研究在4个周期多柔比星、长春碱和达卡巴嗪序贯30Gy 受累部位放疗的基础上加用纳武利尤单抗(序贯或同步治疗),发现序贯治疗组和同步治疗组的41个月 PFS 分别为98%和100%。这些研究表明,维布妥昔单抗和免疫检查点抑制剂均可安全地加入早期预后不良HL患者的标准治疗中,且结果极佳。
4.1.3.反应适应性治疗
为了进一步确定所需的最佳治疗量,多项研究评估了功能影像学,以提供 HL 化疗敏感性的早期指征。其中FDG-PET主要用作疗效的中期指标,其效用通过开发一个高度可重复的5分量表来报告结果而得到增强;与传统的 CT相比,其可检测残留的活动性淋巴瘤。来自两项大型研究的结果说明了使用的 PET 引导的方法,根据治疗的初始反应增加或减少治疗强度。英国国家癌症研究所 RAPID 研究将3个周期 ABVD 后中期 PET 阴性(评分为1或2)的非巨块型早期患者随机分配至 30Gy IFRT 组或无进一步治疗组,结果两组的3年 PFS 和总生存期无显著差异;但在未接受放疗的患者中存在疾病控制较差的趋势,当排除未按照方案接受治疗的患者时,该差异变得具有统计学显著性 (97.1% vs. 90.8%)。
与之相似,对于 ABVD 2 个周期后 FDG-PET 扫描阴性的患者,EORTC/LYSA/FIL H10研究比较了 ABVD 和 INRT 的标准治疗与使用进一步化疗的非放疗方案:如果患者为 PET 阳性,则采用递增策略。PET阳性患者转换为两个周期的递增 BEACOPP 和INRT,而PET 阴性患者(包括预后良好和不良)接受ABVD,序贯INRT 或仅接受ABVD。长期随访显示,在预后良好PET 阴性组中,ABVD+INRT 的10年 PFS 率更优(98.8%和85.4%,p=0.9735;差异检验p<0.0001),而预后不良PET 阴性组10年 PFS 率分别为91.4%和86.5%(p=0.8577;差异检验p=0.1628)。在 PET 阳性患者中,标准 ABVD 和强化 BEACOPP 之间的 PFS 无统计学意义 (p=0.1777)。作者得出结论,对于PET阴性患者,遗漏INRT与较低的10年PFS相关,而对于PET阳性患者,标准治疗与强化治疗之间无显著差异。
对于大包块I/II 期疾病,患者通常先接受化疗序贯放疗。一种类似的PET适应性方案也在大包块患者中进行了评估,中期PET阴性患者省略放疗、阳性患者升级到BEACOPP和30.6 Gy受累野放疗。在94例患者的队列中,PET阴性患者的3年PFS为93.1%,PET阳性患者为89.7%,大多数患者接受了免放疗和强化疗。
上述证据表明,在早期 HL 患者中,使用联合模式治疗可实现极佳的疾病控制,并且更高比例的患者可通过联合模式实现治愈。但对于大约90%的患者,特别是2-3个周期治疗后 PET 阴性的患者,通过单纯化疗亦可治愈。因此基于这些研究,达到一例额外治愈所需的放疗数量在15例至30例之间。鉴于这些优异的结果和放疗的潜在晚期毒性,许多患者可能更倾向于省略放疗时略高的霍奇金淋巴瘤复发风险,而非使用放疗时的长期并发症。然而一般而言,两种方法的结局均极佳,疾病控制的小幅降低似乎不会对总生存期带来不良影响。然而最近一项真实世界研究认为,尽管在这些临床试验中观察到的结果可以在某些患者亚组中重复,但是当剔除放疗时,其他亚组(尤其是不符合试验标准的亚组)表现不佳。
4.1.4晚期疾病
晚期疾病(IIB-IV期)的挑战在于增加持久缓解的患者数量,同时降低长期副作用的风险。有一个长期存在的争议,那就是使用适度的化疗(如 ABVD)还是使用更强化的化疗(如 BEACOPP 递增),前者的耐受性相当好,长期毒性更少但反应不充分和复发率更高,后者的缓解率更高、PFS更优,但毒性更多、长期并发症数量更多。
为改善临床结局,研究使用 FDG-PET 来识别可能从强化或降级治疗中获益的患者,例如AHL2011和 RATHL 研究。在 AHL2011 研究中,患者在2个周期的 BEACOPP 后前瞻性随机接受6个周期的 BEACOPP 和 PET 驱动组(PET2阴性患者接受4个周期的ABVD,阳性患者接受4个周期的BEACOPP)。在长期随访中,两组的 PFS 和 OS 相似。在 RATHL研究中,患者在2个周期的ABVD后进行中期 PET 扫描;阴性患者随机分配接受 ABVD 或AVD(不含博来霉素)再治疗4个周期,阳性患者继续接受 BEACOPP-14 或升级 BEACOPP 强化治疗。在中期 PET 扫描阴性的患者中,ABVD组和 AVD 组的7年 PFS 率和 OS 率相似。研究得出结论,中期 PET 扫描阴性后省略 ABVD 方案中的博来霉素不会降低疗效。在中期 PET 扫描阳性的患者中,BEACOPP升级治疗有效且安全,继发恶性肿瘤未增加。
为进一步改善伴不良预后特征晚期 HL 的结局,评价了将大剂量化疗 (HDCT) 联合自体干细胞移植 (ASCT) 作为初始治疗的一部分。接受4个疗程的含阿霉素方案治疗后达到完全缓解或部分缓解的晚期预后不良 HL 患者在传统化疗后结局良好,并且未显示从 HDCT 和 ASCT 早期强化治疗中额外获益。
以上讨论的策略主要集中于加强治疗以改善晚期霍奇金淋巴瘤患者的预后。最近的一种方案是在标准化疗方案中添加新药,包括维布妥昔单抗和 PD-1 抑制剂(见表1)。在一项 I 期研究中,维布妥昔单抗最初联合ABVD,随后取代博来霉素,结果大多数患者完全缓解;但维布妥昔单抗与博来霉素联合给药时观察到显著的肺毒性,导致禁忌同时使用博来霉素和维布妥昔单抗。基于极高的缓解率,以及维布妥昔单抗联合 AVD 化疗时耐受性良好,后续开展了一项比较 ABVD 与AVD+维布妥昔单抗的随机 III 期研究。与 ABVD 相比,维布妥昔单抗+AVD的 PFS 和 OS 更优。需要生长因子支持的中性粒细胞减少和周围神经病变在维布妥昔单抗+AVD组中更常见,而肺毒性在 ABVD 中更常见。鉴于OS改善,维布妥昔单抗+AVD目前是晚期霍奇金淋巴瘤患者的首选一线治疗。
GHSG 还探索了维布妥昔单抗联合 BEACOPP,并开发了两种新的方案,即更保守的变体BrECAPP(维布妥昔单抗、依托泊苷、环磷酰胺、多柔比星、甲基苄肼、泼尼松)和更侵袭性的变体BrECADD(维布妥昔单抗、依托泊苷、环磷酰胺、多柔比星、达卡巴嗪、地塞米松)。一项随机 II 期研究表明,使用这些含抗CD30 靶向药物的联合方案是可行的,不会损害升级的BEACOPP的疗效。随机 GHSG HD21 研究对比BrECADD 方案与升级的 BEA-COPP,纳入1500例患者,结果显示 BrECADD 作为晚期 HL 成人患者的一线治疗时耐受性和疗效优于eBEACOPP(风险比0.66;p=0.035)。中位随访48个月,BrECADD和 eBEACOPP 的4年PFS分别为94.3%和90.9%,4年总生存率分别为98.6%和98.2%。
最近的临床试验还在新诊断、未经治疗的 HL 患者的一线治疗中在 AVD 化疗中加入抗 PD1 抗体(省略博来霉素)。这些研究首先单独使用 PD-1 抗体2-3个周期,然后继续治疗或加用化疗。两项研究均证实较高的完全缓解率和无进展生存期,表明免疫检查点阻断联合化疗具有良好疗效。在 AVD 化疗中添加帕博利珠单抗也获得相似结果。这些联合方案的耐受性良好,并导致一项在新诊断晚期 HL 患者中比较维布妥昔单抗+AVD(BV-AVD) 化疗与纳武利尤单抗+AVD(N-AVD) 化疗的随机研究;中位随访12.1个月,N-AVD组的 PFS 更优 (94% vs 86%;HR=0.48,p=0.0005)。
老年患者是具有独特挑战性的 cHL 人群,通常无法耐受更强烈的治疗方案。维布妥昔单抗和 PD-1 抑制剂目前正在老年患者中使用,可单独联合耐受性更好的化疗方案,也可在不加化疗的情况下联合使用。在一项纳入≥60岁患者的研究中,晚期 cHL 患者首先接受2个周期的维布妥昔单抗单药治疗,然后接受6个周期的 AVD 化疗,随后接受4个周期的维布妥昔单抗治疗。该方案耐受性良好,老年患者队列的2年无事件生存率、PFS和 OS 率极佳。在老年患者中,维布妥昔单抗也与纳武利尤单抗联合给药,未进行任何化疗。虽然该方案的缓解率很有前景,但许多患者出现疾病进展,特别是在规定治疗时间的情况下,获益的持久性适度。S1826的亚组分析中,对于能够耐受 AVD 化疗联合维布妥昔单抗或纳武利尤单抗的>60岁患者,N-AVD 可改善PFS,且耐受性优于BV-AVD。这些结果表明,将新药纳入一线治疗可能对老年患者有益,但需要额外的研究来优化治疗的剂量和方案,尤其是对于虚弱患者。
总之,随着维布妥昔单抗和纳武利尤单抗加入标准化疗,晚期 HL 的治疗结局显著改善。目前来说,如果在低危患者和老年患者中首选强度较低的方案,则N-AVD化疗是标准方案。如果在具有多种不良预后因素的患者中考虑更强烈的方案,则 BrECADD 是标准方案。但还需要进行随机研究来确定 N-AVD 还是BrECADD 可作为所有晚期患者的首选方案。
4.1.5.结节性淋巴细胞为主型霍奇金淋巴瘤
早期结节性淋巴细胞为主型HL 患者不适合上述策略。无显著风险因素的IA期患者通常可以通过淋巴结切除后“观察等待”或 IFRT约20–30Gy进行管理。更晚期的结节性淋巴细胞为主型 HL 患者通常接受联合化疗,通常与利妥昔单抗联合治疗,因为恶性细胞表达CD20。正在进行临床试验以确定其最佳治疗。
4.2.复发/难治性疾病的治疗
尽管初始治疗的治愈率较高,但5%-10%的 HL患者对初始治疗难治,10%-30%的患者在达到初始完全缓解后复发。HDCT序贯ASCT 是许多初始化疗缓解后复发患者的标准治疗。
4.2.1.原发难治性疾病
原发难治性患者(定义为诱导治疗期间或完成治疗后90天内进展或无应答)的临床病程通常较差,这些患者单纯二线化疗的缓解率低,长期无病生存率仅5%-10%。因此对于这些患者,目前认为大剂量化疗 (HDCT) 联合自体干细胞移植 (ASCT) 是首选的治疗方案。许多回顾性分析表明,与接受化疗的患者相比,接受 ASCT 治疗的患者具有较好的长期结局。但一项接受化疗的原发进展性患者的结局分析中,与接受 HDCT 和 ASCT 治疗的患者相比无失败和总生存期较差。其他研究证实,HDCT 序贯ASCT的结局优于化疗。然而,仍有相当比例在 HDCT 和 ASCT 后复发。
4.2.2.复发性疾病
10%~30%的患者在初始化疗后复发。疾病进展患者通常接受与非霍奇金淋巴瘤患者相似的挽救化疗方案,然后大多数适合移植患者接受ASCT。但尚未开展比较不同传统挽救化疗方案疗效的随机试验,也未发现最佳挽救治疗方案。虽然大多数挽救治疗的总缓解率较高,但挽救治疗的目标是增加达到完全缓解的患者数量。因此最近的研究评价了在挽救化疗中添加维布妥昔单抗或抗 PD-1 抗体是否可以改善完全缓解率并增加随后接受 ASCT 的患者数量。苯达莫司汀+维布妥昔单抗、维布妥昔单抗+纳武利尤单抗、维布妥昔单抗+ICE(异环磷酰胺、卡铂、依托泊苷)、维布妥昔单抗+DHAP(地塞米松、高剂量阿糖胞苷、顺铂)、帕博利珠单抗+吉西他滨+长春瑞滨和多柔比星脂质体 (GVD)、纳武利尤单抗或帕博利珠单抗+ICE,均可获得较高的完全缓解率和大多数患者成功桥接ASCT,部分患者无需化疗。替雷利珠单抗联合吉西他滨和奥沙利铂也获得可喜结果。
尽管在挽救治疗中实现缓解,但单独治疗并不充分,如果不给予巩固治疗,患者通常会复发并死于疾病进展,因此患者需要通常包括 HDCT 和 ASCT 的巩固治疗才能获得持久获益。此外,最近的一项多中心研究表明,在自体干细胞移植前进行包括 PD-1 异抑制剂在内的挽救联合治疗可改善复发和难治性患者的结局。初始 II 期研究表明,在30%-65%的患者中,HDCT序贯ASCT 可产生比传统化疗更好的长期无病生存期。随后的两项随机研究证实,与传统挽救化疗方案相比,HDCT 序贯 ASCT 治疗的复发性 HL 患者的结局得到改善;接受 HDCT 治疗的患者3年无事件生存率均超过50%。
并非所有患者均适合 ASCT 或可从 ASCT 中获益。与年轻患者相比,接受 ASCT 治疗的老年患者的治疗相关死亡率增加,且无事件生存率通常较低。部分持续进展患者接受串联自体干细胞移植或异基因移植(包括半相合移植),表明这些治疗是可行的,但毒性和复发也很常见。
为了预防或延缓移植后的进展,特别是在具有不良风险因素的患者中,一项3期研究在ASCT后患者随机接受维布妥昔单抗巩固治疗或安慰剂治疗。与安慰剂组相比,维布妥昔单抗治疗患者的中位 PFS 显著改善,证实高危患者移植后接受维布妥昔单抗治疗具有获益。一项小型研究在相似患者队列中评价了帕博利珠单抗作为移植后巩固治疗的应用,主要终点为帕博利珠单抗可改善 ASCT 后18个月的无进展生存期,达到主要终点。但ASCT后免疫检查点阻断的获益仍需在随机研究中得到证实。
4.2.3.HDCT和ASCT后复发后的治疗选择
ASCT 后疾病进展的患者预后较差,但近年来自体干细胞移植后复发的HL患者的结局有所改善,很大程度上是由于使用了包括抗体药物偶联物和 PD-1 抑制剂在内的新药。
维布妥昔单抗是一种靶向 CD30 的抗体偶联物,是一种公认的疗法,尤其用于移植后复发的 HL 患者。在移植后患者中的研究显示具有显著疗效。关键 II 期研究给予ASCT 失败的 HL 患者维布妥昔单抗治疗,四分之三的患者出现临床缓解,三分之一的患者达到CR。同样,阻断 PD-1 与 PD-L1 或 PD-L2 相互作用的抗体也可实现高临床缓解率。最近在一项复发性或难治性cHL的随机研究中比较了帕博利珠单抗与维布妥昔单抗,结果帕博利珠单抗治疗显示 PFS 显著改善,支持将 PD-1抑制剂作为自体 ASCT 后复发或不适合自体 HSCT 的患者的首选治疗选择。
在该患者人群中的其他有前景的方法包括联合治疗策略、CAR-T细胞治疗和新型抗体药物偶联物。维布妥昔单抗联合两种检查点抑制剂纳武利尤单抗和伊匹木单抗的三联疗法疗效非常好。CAR-T细胞疗法仍处于早期开发阶段,但已被证明安全,具有非常有前景的临床疗效。最后,固有细胞衔接抗体 AFM13 是一种首创 CD30/CD16A 双特异性抗体,可通过接合和激活NK细胞诱导CD30+肿瘤细胞的选择性杀伤。AFM13联合预活化的脐带血来源NK细胞应用于CD30+淋巴瘤患者(42例HL患者中有37例),ORR和CR率分别为92.8%和66.7%,表明AFM13可能是复发患者有希望的治疗方法。
5.总结
HL 患者的最佳治疗需要准确的诊断和仔细的疾病分期,识别预后不良的特征,进行风险适应性治疗,以潜在地增加治愈的可能性并限制毒性。进一步改善 HL 患者结局的未来方向需要在联合治疗中加入其他新药以提高疗效,并利用新型影像学和外周血分子学检测,以尽量减少治愈所需的治疗暴露。
参考文献
Ansell SM.Hodgkin lymphoma: 2025 update on diagnosis, risk-stratification, and management.Am J Hematol . 2024 Sep 6. doi: 10.1002/ajh.27470.


