Cell:高尿酸血症发病率高或因人类缺乏这一基因,肠道微生物能靶向弥补......
时间:2023-08-10 15:32:47 热度:37.1℃ 作者:网络
高尿酸血症是由于尿酸产生过多或排泄过少,造成血液中尿酸浓度超过正常值的一种病症。尿酸过高会在关节、软组织和其他部位形成晶体沉积,引发痛风。基于2018-2019年慢性病及危险因素监测数据表明,中国成人居民高尿酸血症患病率为14.0%,并呈年轻化趋势,已成为仅次于糖尿病的第二大代谢性疾病[1]。
目前研究认为,尿酸高可能是由多种原因造成的,主要包括遗传因素、饮食习惯(如过度摄入高嘌呤食物)、肾脏疾病、某些药物的副作用、糖尿病等。在大多数哺乳动物中,尿酸的消除是由尿酸酶促进的。然而在古人类进化的早期,尿酸酶基因就发生了渐进性突变,使其活性下降,直到功能完全丧失,所以人类中的尿酸酶是一种“伪基因”(无功能)的存在。这种先天性的基因缺陷诱导了人们很容易受后天饮食等因素的影响,引起高尿酸血症的发生。
2023年8月3日,Cell主刊发布一项题为“A widely distributed gene cluster compensates for uricase loss in hominids”的重磅研究[2],发现肠道微生物群中的厌氧菌能够代谢尿酸,维持血清中尿酸的低水平、降低痛风的风险,以弥补人类先天性尿酸酶基因缺乏的缺陷。揭示了肠道微生物群在尿酸排泄中的作用,并强调了微生物群在靶向治疗高尿酸血症的潜力。

1 尿酸代谢在人类肠道细菌中广泛存在
为了鉴定代谢尿酸肠道细菌的类型,学者们通过尿酸培养系统发育多样的人类肠道细菌菌株库,并使用液相色谱-质谱法对剩余尿酸进行定量(图1)。结果表明尿酸代谢基因广泛分布于肠道细菌中,尿酸消耗在肠道细菌中非常普遍,肠道细菌可以将尿酸转化为黄嘌呤和短链脂肪酸。
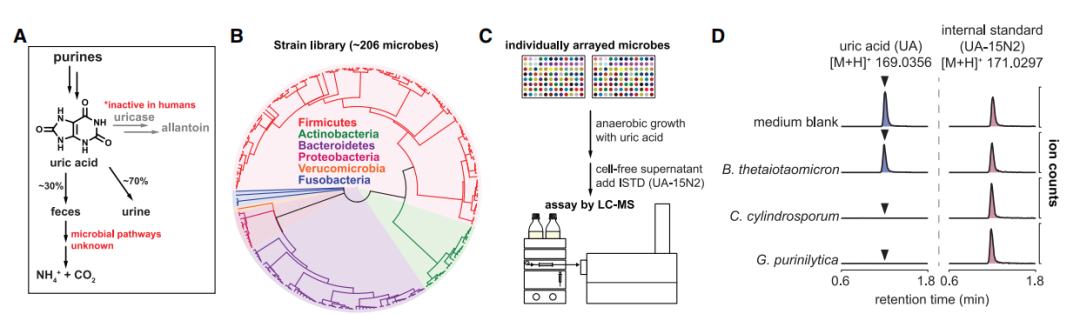
图1. 厌氧尿酸代谢在人体肠道细菌中的作用
2 大肠杆菌在厌氧条件下将尿酸转化为醋酸盐
该研究中观察到大多数含有尿酸基因的菌株是兼性或专性厌氧菌,进一步对两种兼性厌氧菌(大肠杆菌和粪肠球菌)的比较表明,尿酸仅在厌氧条件下消耗(图2)。作者推断代谢尿酸的基因可能是肠道厌氧菌特有的。
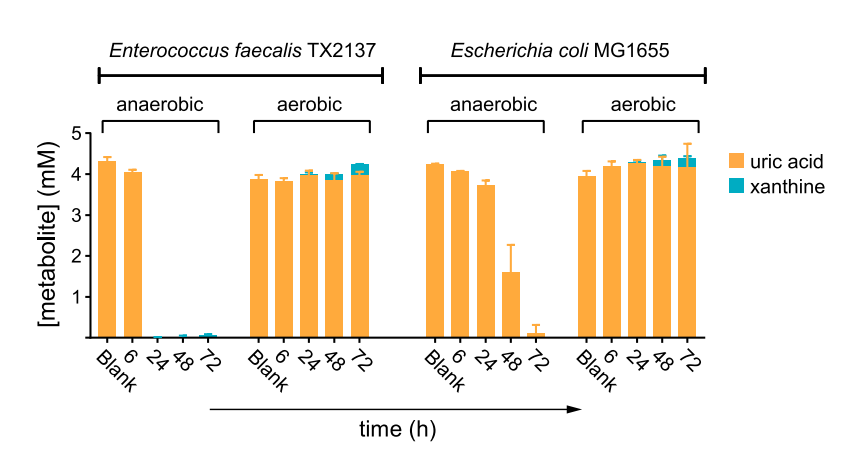
图2. 粪肠球菌和大肠杆菌在厌氧环境中(而非有氧)消耗尿酸
3肠道细菌能弥补小鼠尿酸酶的不足,针对厌氧肠道微生物的抗生素增加了人类患痛风的风险
研究者发现在尿酸酶缺乏的小鼠中,肠道微生物群的紊乱会导致严重的高尿酸血症,肠道细菌能够弥补小鼠尿酸酶的不足。克林霉素是临床中常见的厌氧型抗生素,研究进一步发现,与使用复方新诺明的患者相比,使用克林霉素的患者被诊断为痛风的风险显著增加(P = 0.0026)。表明具有抗厌氧菌活性的广谱抗生素会破坏厌氧性肠道微生物群引起痛风,进一步佐证了肠道微生物群中的厌氧菌在尿酸代谢中扮演的重要角色。
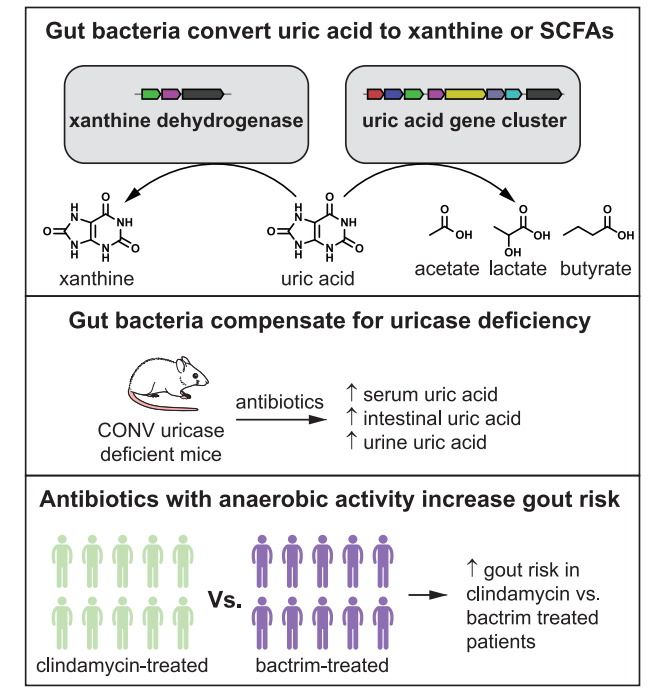
与尿酸代谢相关的肠道微生物菌群的减少可以部分解释为什么随着工业化的发展(饮食结构变化和抗生素的滥用),高尿酸血症和痛风的发病率越来越高。而这项最新的研究结果告诉我们一个重要的信息:厌氧性肠道微生物群对先天性尿酸酶基因的缺失发挥了重要的代偿作用,维持机体尿酸水平处于相对正常水平。所以在临床中,对于有高尿酸血症和痛风发生风险增加的患者,我们应慎用厌氧型抗生素,以防对肠道微生物群的破坏。另外,促进肠道尿酸代谢或是治疗高尿酸血症患者的潜在治疗方法,由尿酸代谢细菌组成的生物治疗产品可能是未来治疗高尿酸血症和痛风的一种重要方式。
肠道菌群的相关研究这些年一直是生命科学领域的热点。2023年8月4日,Science和Cell两大期刊连发4文关于肠道菌群的最新研究(包括上述这篇文章)[2-5]。值得一提的是Science杂志的一篇题为“Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target”的研究,通过高通量筛选和结构修饰获得一种选择性的菌源DPP4抑制剂Dau-d4,被发现可改善糖尿病小鼠的GLP-1活性和葡萄糖稳态,从肠道微生物的视角提供了一个潜在糖尿病的治疗靶点[5]。
总而言之,肠道菌群与代谢性疾病的研究仍处于不断发展的阶段。未来的研究将进一步揭示肠道菌群与包括糖尿病和高尿酸血症等代谢性疾病之间的复杂关系,并为预防和治疗这些疾病提供新的思路和方法。
文献来源:
[1]Zhang M, Zhu X, Wu J,et al. Prevalence of Hyperuricemia Among Chinese Adults: Findings From Two Nationally Representative Cross-pal Surveys in 2015-16 and 2018-19[J]. Front Immunol. 2022 Feb 7;12:791983. doi: 10.3389/fimmu.2021.791983;
[2]Liu Yuanyuan,Jarman J Bryce,Low Yen S et al. A widely distributed gene cluster compensates for uricase loss in hominids.[J] .Cell, 2023, 186: 3400-3413.e20;
[3]Pierre Joseph F,Peters Brian M,La Torre Diana et al. CandidaPeptide YY: A Paneth cell antimicrobial peptide that maintains gut commensalism.[J] .Science, 2023, 381: 502-508;
[4]Huang Wei,Rodrigues Janneth,Bilgo Etienne et al. Delftia tsuruhatensis TC1


