Nature子刊:液体活检用于早筛新方法
时间:2023-08-04 11:33:21 热度:37.1℃ 作者:网络
胞嘧啶-鸟嘌呤(CpG)二核苷酸中胞嘧啶碱基的甲基化对多种生物过程至关重要,包括基因表达、印迹和可移动遗传元件的抑制。5mC可定义细胞谱系,而胞嘧啶甲基化失调是癌症等疾病的标志。5mC测序最常用的方法是使用化学脱氨法。在基于亚硫酸氢盐的测序(BS-Seq)中,亚硫酸氢钠与未修饰的胞嘧啶反应导致C到T的转变。由于5mC与亚硫酸氢盐反应缓慢,保持为C。然而,BS-seq至少存在两个限制。首先,亚硫酸盐会破坏DNA。其次,无法区分5mC和5-羟甲基胞嘧啶(5hmC)。5mC和5hmC在功能上经常相互间拮抗,因此解析5mC和5hmC在很重要。 最近开发的几种表观遗传测序技术部分解决了与BS-Seq相关的局限性。例如,氧化亚硫酸盐测序(oxBS-Seq)可以解决5mC和5hmC,但需求DNA量较大。化学脱氨法TET辅助吡啶硼烷测序(TAPS)也可以测序修饰的胞嘧啶。与此同时,利用酶而不是化学脱氨的方法也得到了发展。ACE-Seq是第一个使用DNA脱氨酶APOBEC3A (A3A)来选择对未修饰的Cs和5mCs进行脱氨,同时使受保护的5hmCs不被转化的技术。同样,EM-Seq在酶脱胺之前利用TET和βGT酶来获得类似亚硫酸盐合并5mC和5hmC的读数。 近日,一组来自宾夕法尼亚大学的研究团队在杂志Nature Chemical Biology上发表了一篇题为“Direct enzymatic sequencing of 5-methylcytosine at single-base resolution”的文章。在这篇文章描述了如何实现完整的DM-Seq方法来直接对5mC进行单独测序。与TAPS的比较发现了5mC检测的偏差,可能是由于DHU碱基的聚合酶扩增不良。最终,作者发现,使用纳克级DNA,DM-Seq在测序覆盖范围和5mC的准确定量方面优于BS-Seq,有望应用于液体活检和早期癌症检测等。 图片来源:Nature Chemical Biology DM-seq基本原理概述 尽管酶法脱氨方法有希望,但这些方法受到C和5mC都被A3A脱氨这一事实的限制。为了开发一种精确且无损的流程来单独研究5mC,作者设计保护未修饰的CpG,只留下5mC在CpG环境中被破坏,就可以实现直接的5mC检测(如下图)。DM-Seq采用了两种关键的DNA修饰酶:一种是新DNA甲基转移酶,另一种是能够精确区分胞嘧啶修饰状态的DNA脱氨酶。将这些活性与脱氨酶抗性adapter偶联,可以通过测序中的C-to-T转换直接准确检测5mC。 DM-seq原理概述。图片来源:Nature Chemical Biology
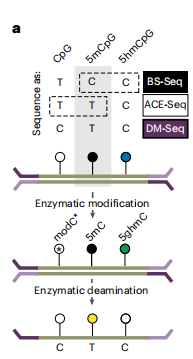
5羧甲基胞嘧啶是DM-Seq的候选修饰碱基
DM Seq的成功至少需要两个条件:将保护基团有效地转移到未修饰的CpG上,并完全保护新生成的修饰碱基不受A3A介导的脱胺作用的影响。为了创建一个抗DNA脱氨酶APOBEC3A(A3A)脱氨的修饰胞嘧啶碱基,研究团队筛选了一系列的工程化甲基转移酶(MTase*)以及其底物SAM。结果发现5-羧甲基胞嘧啶(5cxmC)具有尺寸和负电荷的特征,可以抵抗酶的脱胺作用(如下图)。
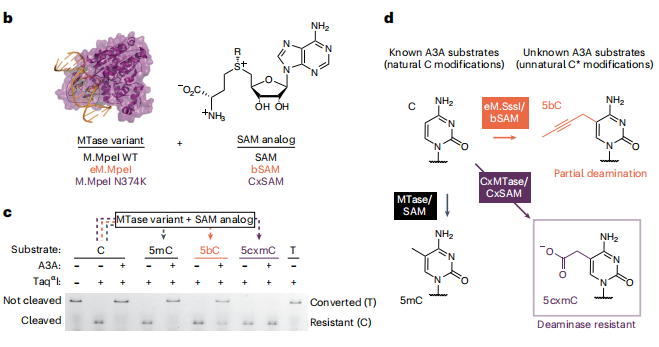
生成5cxmC的DM-seq策略直接测序5mC。
图片来源:Nature Chemical Biology
混链样本的DM-Seq检测使DNA更有效的羧甲基化
作者发现此方法有DNA互补链的CpG羧甲基化不完全的问题,因此设计了一个5-丙炔基胞嘧啶(5pyC)adapter,通过5pyC adapter实现的拷贝链合成克服了不对称DNA羧甲基化的挑战。在此基础上,作者进一步优化了流程,进一步提高了DNA羧甲基化效率。在最终的DM-Seq工作流程中(如下图), 5pyC adapter连接到gDNA片段上并复制以产生一条只含有5mCs的链来代替C,然后gDNA被CxMTase(作用于未修饰的CpGs)和βGT的糖基化(用于5hmCs)所保护。在PCR扩增和测序之前进行A3A脱氨。
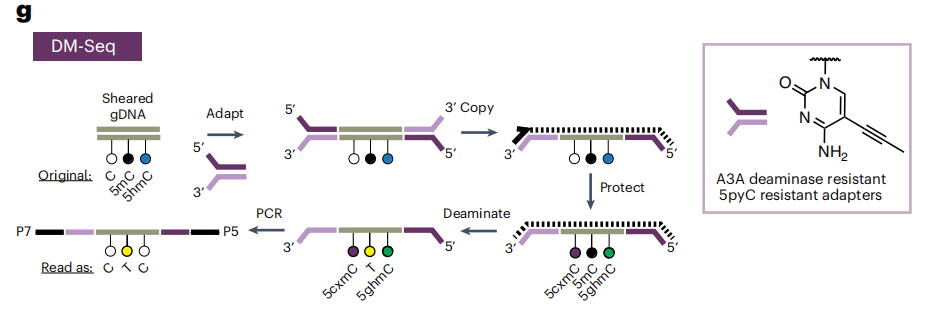
完整DM-seq工作流程。图片来源:Nature Chemical Biology
DM-seq性能比较
作者使用三种lambda噬菌体gDNA样本来将DM-seq工作流程BS-seq进行比较。通过定量PCR (qPCR)检测, DM-Seq样品的可扩增DNA含量是BS-Seq样品的22倍,意味着DM-seq可以检测样本量更少的核酸样品(Ct:17.0 vs 12.5;下图a)。未修饰的lambda噬菌体gDNA的全基因组比较结果中,BS-Seq的CpG不转化率低(0.23%),而DM-Seq的脱氨保护率高(96.7%),验证了复制链流程将CpG转化为5cxmCpG的效率。用M.SssI处理的gDNA样本,91.3%的CpGs被BS-Seq保护;而在DM-Seq中,93.1%的CpGs被A3A脱胺。在M.CviPI MTase条件下,BS-Seq和DM-Seq在全基因组水平上检测到的5mCpG相似(图b)。以上结果均表明DM-Seq可在单基分辨率下精确检测5mCpG。
作者还将DM-Seq与新兴的5mC测序技术TAPS进行了比较,意外发现了TAPS会导致5mC检测偏差,从已有证据推测可能是由于TAPS流程中5mC需转变成二氢尿嘧啶(DHU),而含DHU的DNA链扩增的效率变低,因此降低了其检测5mC的灵敏度。

DM-Seq在单碱基分辨率下准确地检测5mCpG,并且比TAPS更准确。图片来源:Nature Chemical Biology
DM-Seq在表征人类肿瘤方面优于BS-Seq
作者将DM-Seq应用于人类胶质母细胞瘤GBM样本,因为这种癌症已被广泛表征为其异质性胞嘧啶甲基化模式。尽管哺乳动物脑组织中典型地富含5hmC,但两项利用oxBS-Seq的独立研究得出结论,5hmC在GBM中高度缺失。作者从手术切除的人类GBM中获得了gDNA,并添加了三个spike in对照来验证DM-Seq效率(图a)。
结果显示,尽管BS-Seq弥补了2.8倍的低文库得率,但DM-Seq在标准化测序文库中仍然比BS-Seq提供更多的信息内容。与BS-Seq相比,DM-Seq捕获的1kb非重叠独特bin至少增加了5.9倍,这表明DM-Seq能够更好地区分基因组关键位上的5mC和5hmC,并且可通过甲基化水平来预测患者的结局。作者进一步的研究还揭示了BS-Seq(5mC+5hmC)和DM-Seq(仅5mC)两个数据集之间存在较强的相关性;因为GBM中5hmC高度缺失,基于这两种方法生成的图谱总体相似。在GBM相关的CpG位点中,DM-Seq报告了61.4%的5mC修饰,与BS-Seq相比低14.3%,表明其可量化具有功能重要性CpG上的5hmC“盲点”。上述结果表明,与BS-Seq相比,通过DM-Seq直接检测5mC能够揭示临床肿瘤样本中具有预后意义的CpG。
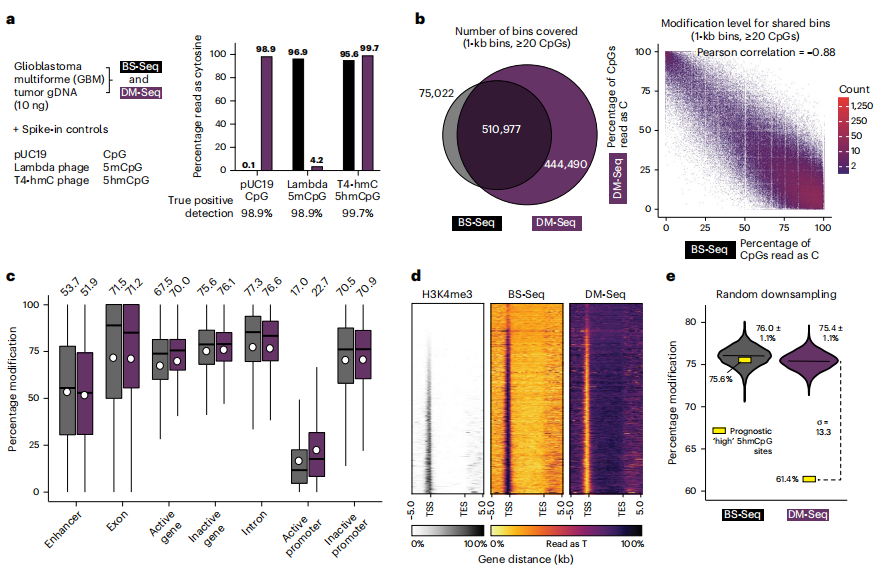
DM-Seq直接检测人GBM中的5mCpGs。
图片来源:Nature Chemical Biology
总结与讨论
在这里,作者描述了DM-seq,一种非破坏性和仅酶的工作流程,可以使用纳克级DNA在单碱基分辨率下检测5mC。DM-Seq采用两种关键的DNA修饰酶:一种新DNA甲基转移酶和一种能够精确区分胞嘧啶修饰状态的DNA脱氨酶,与抗脱氨酶adapter耦合,可以通过测序中的C-to-T转换准确检测5mC。结果发现DM-Seq,不会混淆5mC和5-羟甲基胞嘧啶,揭示了临床肿瘤样本中具有预后重要性的CpGs。因此,DM-Seq提供了一种全酶、无损、可靠和直接的方法来单独读取5mC。作者还在实验中意外发现,TAPS低估了修饰的碱基,这一特征可能归因于DHU的产生。具有高密度顺式DNA修饰的区域可能特别容易出现扩增不足。
研究团队认为DM-Seq的开发突出了目前5mC定位方法的局限性,这是一个至关重要的问题。GBM分析揭示了直接用DM-Seq在特定CpGs上对5mC进行测序可以提供独特的预后信息。可以很容易地想象,将这项技术扩展到稀疏DNA样本的分析,例如用于早期癌症检测的无细胞DNA。由于其非破坏性和无DHU的工作流程,DM Seq也可以与快速发展的第三代测序平台相结合。最终,通过直接定位5mC,而不是修饰的胞嘧啶,DM-Seq可以更好地确定单独5mC的生物学功能。


