Zoonoses: 新冠病毒不断变异,给疫苗研发带来哪些挑战?
时间:2022-02-13 19:21:16 热度:37.1℃ 作者:网络
自2019年底首次报道以来,由新型冠状病毒SARS-CoV-2感染引起的新冠肺炎(COVID-19)造成了全球大流行。截至2022年1月5日,全球已有近3亿感染病例,超过540人死于这种烈性传染性疾病,因新冠肺炎疫情全球大流行造成的经济损失愈10万亿美元。
在过去的2年中(2020和2021年),SARS-CoV-2病毒在人类宿主体内持续进化,导致了各种病毒变异体不断出现,这些变异体传播力、引发的疾病严重性及免疫逃避能力各异。虽然以前所未有的速度开发出新冠疫苗并已用于免疫接种,但SARS-CoV-2病毒变异体的出现对这些已批准应用的疫苗效力造成了持续威胁。
2022年2月8日,Zoonoses在线发表了德克萨斯大学医学分部史佩勇教授和深圳湾实验室传染病研究所特聘研究员刘洋博士团队评述论文《SARS-CoV-2 Variants and Vaccination》(新型冠状病毒变异体与疫苗接种)。
该评述概述了SARS-CoV-2病毒关键变异体及其刺突蛋白突变,并对其在病毒复制、传播和免疫逃避中的意义进行了阐释。
自2019年底首次报道SARS-CoV-2病毒后,该病毒不断进化并导致各种变异体不断出现。在这些SARS-CoV-2病毒株中,部分变异体在病毒进化过程中相较于其他突变株更具竞争优势。D614G变异体是首个出现的SARS-CoV-2病毒刺突蛋白变异株,其可增加病毒在人体上消化道的复制能力;该变异体出现后,迅速取代了2020年6月前的几乎全部SARS-CoV-2病毒株。随后,α变异株(B.1.1.7变异株)在英国出现,并迅速在全球其他地区蔓延。
2020年10月,德尔塔变异株(B.1.617.2变异株)在印度出现并迅速扩散并替代全球α变异株。2021年11月率先在南非发现的奥密克戎变异株在全球多个国家爆发式扩散,其传播速度远远快于德尔塔株,且能逃避多种单抗和疫苗诱导的中和抗体作用。美国甚至报道了单日超过100万例奥密克戎变异株感染病例(图1)。
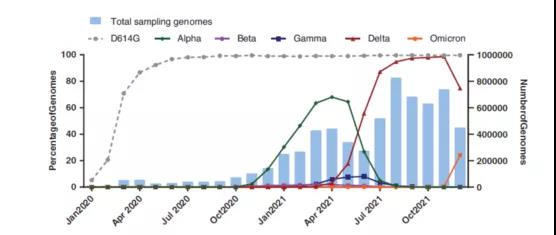
图1 不同变异株随时间变化在SARS-CoV-2病毒基因组序列中的突变频率
刺突蛋白是SARS-CoV-2病毒感染性和传播力的主要决定因子。D614G替换是刺突蛋白的首个显性突变,可显着提升病毒变异株的感染性和传播力。发生于刺突蛋白受体结合域的N501Y突变是α变异株的最重要氨基酸替换,极大提升了与人体ACE2受体的亲和性,导致上消化道的快速感染和高度病毒传播力。德尔塔变异株存在刺突蛋白P681R突变,可提升病毒复制能力和感染能力。奥密克戎变异株含有超过30种刺突蛋白突变,部分突变可见于α、β、γ、德尔塔等变异体,而K417N、E484K、N501Y等突变可提高病毒感染性、传播性和免疫逃避能力。
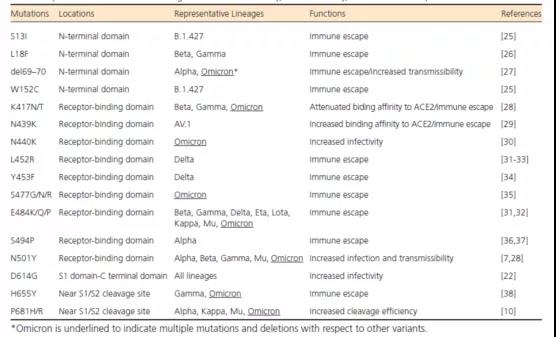
表1 可增加SARS-CoV-2病毒感染性、传播性和免疫逃避能力的重要突变
数种新冠疫苗已获批应用,以在全球构建群体免疫屏障。BNT162b2 mRNA疫苗是应用最广泛的新冠疫苗之一,在北美和欧洲广泛应用。鉴于SARS-CoV-2病毒刺突蛋白频繁突变,一些新现变异株对接种疫苗或自然感染后产生的抗体中和作用敏感性下降。
通常采用测定嵌合刺突蛋白变异株的SARS-CoV-2病毒对人体血清的中和效价,以评价疫苗的免疫接种效果。α变异株具有更高病毒感染性和传播力,但诱导产生的中和抗体滴度与野生毒株相仿;D614G和代表性德尔塔变异株诱导产生的中和抗体滴度略低于野生毒株(图2)。
不幸的是,两剂BNT162b2 mRNA疫苗接种后并不足以诱导产生强烈的抗奥密克戎变异株抗体中和作用,而感染和免疫接种人群抗奥密克戎变异株中和抗体滴度显着低于野生毒株,但BNT162b2 mRNA疫苗加强针(第三剂)可诱导产生强烈的抗奥密克戎变异株中和抗体作用。
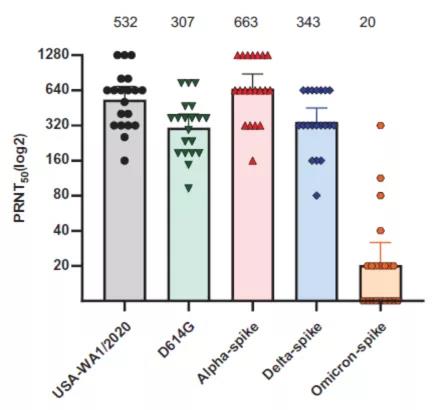
图2 不同SARS-CoV-2病毒变异血清中和抗体效价
迄今,BNT162b2 mRNA疫苗第三剂接种后诱导的中和抗体水平在接种4个月后仍然维持在高水平,但在接种第三剂4个月后的中和抗体持久性仍有待于进一步调查。基于既往研究结果,建议采取双管齐下策略:一方面应用目前已获批的安全有效疫苗接种加强针;另一方面改进现有疫苗刺突蛋白序列以匹配奥密克戎和其他新现变异株,而mRNA疫苗技术则为刺突蛋白序列快速改进提供了可能。亟需真实世界的疫苗效果数据和实验室研究,以指导这种双管齐下免疫策略的实施。
新冠肺炎疫情全球大流行2年来,多种SARS-CoV-2变异株不断出现,目前流行的奥密克戎可能并不是最后一种变异体。虽然这些变异体能逃避疫苗接种和/或自然感染的免疫保护作用,但有证据表明疫苗接种可将重症病例比例降至最低,并可显着降低入院率和死亡率。群体免疫、接种加强针、戴口罩和保持社交距离是最终结束新冠肺炎疫情的最有效策略。
作者简介

刘洋,博士,深圳湾实验室传染病研究所特聘研究员
主要研究领域:新发和再发病毒传染病的遗传进化分析、烈性病毒的致病机理和传播机制、 新发和再发病毒传染病的防控新策略。2013年获清华大学迷你盖茨基金一等奖、2014年获清华大学一等奖学金、2015年和2017年两次获得博士生国家奖学金、2017年获全国病毒学学术研讨会论文一等奖、2018年获吴瑞奖学金。刘洋博士发现并验证了新冠病毒上多个促进病毒感染和传播的重要突变,搭建了多种研究新冠病毒的重要反向遗传学平台,并在世界上首次评估了新冠疫苗对多种突变新冠病毒中和能力的变化,为新冠病毒疫苗的改进提供了第一手信息。研究成果发表于Nature、New England Journal of Medicine、Cell、Nature Medicine、Nature Microbiology、Nature Communications等国际知名期刊。

史佩勇,博士,美国德克萨斯大学医学分部讲席教授
美国微生物学院院士、美国科学院顾问;同时受聘为美国杜克大学-新加坡国立大学教授、中囯科学院武汉病毒所特聘研究员,并担任国际三大病毒学杂志及自然疫苗子刊编辑和编委,拥有多项世界专利和美国专利。
Pei-Yong Shi教授是近年来活跃于病毒学领域研究前沿的杰出华人科学家之一,主要从事RNA病毒、抗病毒药物和疫苗研发等方面研究,至今已发表SCI论文300余篇,研究成果发表于Nature、Science、New England Journal of Medicine、Cell、PNAS、Nature Medicine、Nature Microbiology、Cell Host & Microbe等国际Top期刊;并应邀在Science、Lancet Neurology、Cell Host & Microbe等国际著名期刊上发表评论和综述。
原始出处:
Yang Liu, Jianying Liu, Pei-Yong Shi. SARS-CoV-2 Variants and Vaccination. Zoonoses, 08 February 2022,


