Front Immunol:免疫抑制疗法不同程度地调节类风湿关节炎患者对COVID-19 mRNA疫苗的体液和T细胞特异性反应。
时间:2021-10-11 17:01:20 热度:37.1℃ 作者:网络

目的:评价不同免疫抑制疗法治疗的类风湿性关节炎(RA)患者在接种后通过抗区域结合域(RBD)抗体和T细胞特异性免疫应答诱导的SARA- COV -2特异性免疫应答,以及疫苗对疾病活动的临床影响的安全性。
方法:择在过去2周内完成BNT162b2-mRNA疫苗接种的医护人员和类风湿关节炎患者作为研究对象。血清学应答通过定量抗RBD抗体来评估,而细胞介导的应答通过全血试验定量干扰素(IFN)-g-对刺激肽的应答来评估。流式细胞仪分析鉴定对棘波刺激有反应的细胞。通过DAS28crp进行临床检查,评估RA疾病活动性,并记录局部和/或全身性临床不良事件。在RA患者中,正在进行的治疗方案在疫苗接种期间根据美国风湿病学会的适应症进行了修改。
结果:我们前瞻性地招募了167名HCW和35名RA患者。尽管CTLA-4抑制剂(中位数:465BAU/mL,IQR:103~1189,p<0.001)或IL-6抑制剂(中位数:492BAU/mL,IQR161~1007,p<0.001)显著低于HCW(中位数:2351BAU/mL,IQR:1389~3748),但几乎所有患者都检测到了RBD抗体(中位数:465BAU/mL,IQR:103~1189,p<0.001)。在大多数接受生物治疗的RA患者中,T细胞特异性应答得分为阳性[24/35,(69%)],在接受生物治疗的患者中,如IL-6抑制剂(中位数:33.2pg/mL,IQR6.1-73.9,p<0.001)、CTLA-4抑制剂(中位数:10.9pg/mL,IQR3.7-36.7,p<0.001)和肿瘤坏死因子抑制剂(中位数:89.6pg/mL,IQR17.8pg/mL)均为阳性。P=0.002)与HCW(中位数:343pg/mL,IQR:188-756)相比。类风湿关节炎(RA)患者血清中抗RBD抗体滴度与特异性T细胞应答显著相关(Rho=0.432,p=0.009)。IFN-GT细胞应答由CD4+和CD8+T细胞介导。最后,接种疫苗后,类风湿性关节炎患者的疾病活动性没有明显增加。

图1 类风湿关节炎患者接种SARS-CoV-2疫苗后的抗体和T细胞应答。167例HCW和35例RA患者按药物治疗分为4组:TNF抑制剂加或不加DMARD组(n=7)、IL-6抑制剂加或不加DMARD/CCS组(n=8)、CTLA-4抑制剂加或不加DMARD/CCS组(n=13)、DMARD加或不加CCS组(n=7)。类风湿性关节炎患者的体液免疫和细胞免疫之间存在相关性(C)。检测血浆或血清中SARS-CoV-2特异性抗RBD抗体。抗RBDIgG以结合任意单位(BAU)/mL表示,≥值7.1为阳性。在减去背景后,IFN-γ水平显示为中位数。虚线表示每次检测的截止值(峰值为16pg/mL,抗RBD为7.1BAU/mL)。每个黑点代表一个样本,红色水平线代表中值。统计分析使用带Bonferroni校正的Mann-Whitney U检验,p≤0.0125被认为是显著的。采用非参数Spearman秩和检验评估分析方法之间的相关性。双侧p值<0.05被认为具有统计学意义。CCS,皮质类固醇;DMARD,抗风湿药物;RA,类风湿性关节炎;单抗,抗体;RBD,受体结合域;HCW,卫生保健工作者。
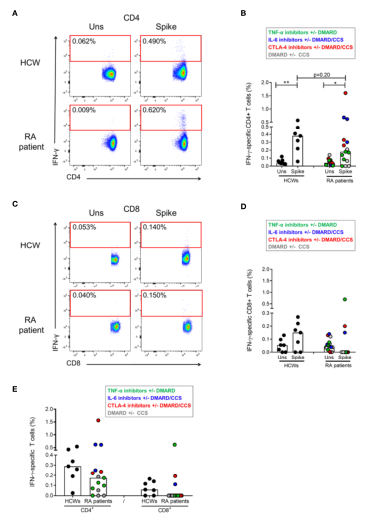
图2 流式细胞术检测IFN-g-S特异性T细胞应答。将HCW(n=7)和RA(n=15)外周血单个核细胞(PBMC)在刺激肽池中体外刺激24小时,用流式细胞仪检测IFN-g特异性T细胞的频率。(A)曲线显示具有代表性的HCW患者和RA患者的CD4+T细胞亚群中IFN-gin的频率。(B)与未刺激条件相比,HCW和RA患者的CD4+T细胞特异性应答显示。(C)曲线显示IFN-g的频率。(E)HCW和RA患者的CD4+和CD8+T细胞应答频率(减去非刺激状态值后)。每个点代表不同的HCW或RA个体,黑线代表中位数。类风湿关节炎患者用不同的颜色编码,每种颜色对应不同的治疗方法,如图中图例所示。使用Mann-Whitney检验进行统计分析,如果≤为0.05时,p值被认为是显著的。*p=0.012和**p=0.004。干扰素,干扰素;类风湿性关节炎,类风湿性关节炎;卫生工作者,医护人员。
结论:本研究首次表明新冠肺炎基因疫苗诱导的抗体特异性和全血刺激性T细胞应答出现在大多数RA患者中,他们在疫苗接种期间采取了暂停免疫抑制治疗的策略。然而,特异性反应的大小取决于实施的免疫抑制治疗。在RA患者中,BNT162b2疫苗是安全的,疾病活动保持稳定。
原文出处:
Picchianti-Diamanti A, Aiello A,et al,ImmunosuppressiveTherapies Differently Modulate Humoral- and T-Cell-Specific Responses to COVID-19 mRNA Vaccine in Rheumatoid Arthritis Patients.Front Immunol 2021;12


