超2千例中国汉族健康人BRCA基因筛查:近半随访2年,揭示携带者癌症风险显著增加
时间:2025-03-29 12:09:09 热度:37.1℃ 作者:网络
有害的BRCA1/2(BRCA)突变会增加患BRCA突变相关恶性肿瘤的风险,这些肿瘤包括乳腺癌、卵巢癌、前列腺癌和胰腺癌。BRCA胚系变异表现出显著的种族多样性。然而,针对中国汉族人群的相关研究有限,这限制了在这一庞大族群中制定BRCA突变筛查策略的进展。研究者对2080名看似健康的中国汉族个体以及522名BRCA突变相关癌症患者的BRCA突变谱进行了分析,其中包括单核苷酸变异、插入/缺失以及大片段基因组重排(LGR),以此来确定中国汉族人群,尤其是东部汉族人群的BRCA基因背景。研究者对来自健康组的1005名参与者(其中包括11名BRCA致病性/可能致病性(PLP)变异携带者和994名无PLP变异个体,包括3名大片段基因组重排携带者)的癌症发病事件进行了监测。
与癌症患者相比,健康的中国汉族个体展现出独特的BRCA突变谱,PLP变异的发生率为0.53%(1/189),同时LGR的发生率为2080人中有3人。BRCA1 c. 5470_5477del变异在北方汉族人群中发生率较高(0.44%),并且与乳腺癌具有相关性。在随访期间,3名LGR携带者均未患癌。研究者计算得出,与无PLP变异的个体(平均年龄48.47岁,中位随访时间为16个月)相比,携带BRCA PLP变异的个体(平均年龄42.91岁,中位随访时间为10个月)患BRCA突变相关癌症的相对风险为135.55(95%CI 25.07-732.88)。
中国汉族人群独特的BRCA突变特征突显了开展标准化的基于人群的BRCA变异筛查的潜力,这有助于加强对BRCA突变相关癌症的预防和治疗。
研究背景
乳腺癌易感基因BRCA1和BRCA2(BRCA)的有害胚系变异会显著增加罹患 “BRCA突变” 相关肿瘤的风险,这些肿瘤包括乳腺癌、卵巢癌、胰腺癌和前列腺癌。对有癌症家族史的人群进行这些变异的筛查,加强了对高危个体的早期预防和干预。
大规模基因组数据库拓展了我们对主要人群中BRCA基因背景的认识,突显了白种人、德系犹太人、西班牙裔、非裔美国人以及亚洲人群中,BRCA胚系变异在流行率和突变谱方面的种族多样性。此外,令人惊讶的是,研究发现基于人群的筛查能够识别出的有害变异携带者数量,几乎是传统基于家族病史筛查的两倍。
在过去五年里,中国发表了40多项关于BRCA突变相关癌症患者突变谱的研究。其中一些研究揭示了乳腺癌和卵巢癌病例对照研究中健康对照组的突变情况。然而,由于中国地域广阔,汉族内部存在显著的基因多样性,针对主要人群(中国汉族)中突变流行率的调查,以及关于变异筛查是否能带来益处的后续研究仍然有限。区域性研究记录了台湾和澳门等地区单核苷酸变异(SNV)和小片段插入缺失事件(InDel)的不同流行率。也曾进行过全国范围的变异筛查,但参与者主要来自北方汉族和岭南汉族。此外,大片段基因组重排(LGR)作为导致BRCA功能沉默的另一个因素,在这一人群中的报道较少。目前仍不确定,在这一人群中扩大BRCA筛查范围,是否能在识别高危个体方面带来更多益处。我们对BRCA变异在基因组和功能方面认识的这些空白,阻碍了占全球人口20%以上的中国汉族人群BRCA突变筛查策略的建立和标准化。
在这项描述性研究中,研究者整合了2080名看似健康的个体和522名BRCA突变相关癌症患者的BRCA1和BRCA2外显子的NGS数据,以揭示中国汉族普通人群中有害BRCA变异(包括SNVs、InDels和LGRs)的独特基因模式,特别关注占中国汉族人口25%的东部汉族人群。此外,通过对健康人群长达24个月的临床随访数据,研究者证明了BRCA胚系突变筛查有助于中国汉族看似健康人群中BRCA突变相关癌症的风险分层和早期检测。
研究方法
从2021年6月至2023年2月,复旦大学附属华山医院健康管理中心招募了2080名否认个人及家族癌症病史的看似健康的参与者。所有参与者均年满18岁,其病历由两名医生进行盲审,以确认入组时无肿瘤情况。此外,招募了复旦大学附属华山医院的121名三阴性乳腺癌(TNBC)患者、181名转移性去势抵抗性前列腺癌(mCRPC)患者、215名胰腺导管腺癌(PDAC)患者以及5名高级别卵巢癌(HGOC)患者,作为BRCA突变相关癌症组。所有癌症患者入组接受BRCA突变筛查,目的是根据其基因型制定手术及放化疗策略 。
通过NGS对BRCA1和BRCA2进行胚系突变分析,根据美国医学遗传学学会(ACMG)指南,将BRCA1(MANE NM_007294.4)和BRCA2(MANE NM_000059.4)中的胚系变异分为五类,包括良性、可能良性、意义未明的变异、可能致病性变异和致病性变异。在一个基因的两个或更多区域存在显著CNV的样本被视为携带BRCA LGRs 的候选样本,并使用多重连接探针扩增(MLPA)进一步验证。
看似健康的参与者通过检测后咨询,获得了详细的BRCA突变检测结果。携带BRCA致病性/可能致病性(PLP)变异的参与者接受了临床肿瘤学家关于自我检查和健康随访的指导。从2021年6月至2023年6月,2080名健康个体中有1005人每6至14个月到健康管理中心进行肿瘤风险筛查,筛查项目包括乳房钼靶/磁共振成像、乳房体格检查(针对乳腺癌风险)、经阴道超声和CA125检测(针对卵巢癌风险)、腹部CT/磁共振成像、CA199检测(针对胰腺癌风险,仅对携带PLP变异的个体进行影像学检查),以及直肠指检、前列腺特异性抗原(PSA)检测(针对前列腺癌风险)。在项目的24个月期间,412人接受了一次检查,375人接受了两次检查,218人接受了三次随访。
根据ACGS分类指南,将通过ACMG标准获得的意义未明变异进一步分为六类致病性:高风险、中高风险、中等风险、中低风险、低风险和极低风险。鉴于BRCA的P/LP变异出现于人类近代史,而不是来自非人类物种,基于进化保守的功能预测工具(如SIFT和polyphen2)不适合注释错义VUS(意义未明变异)。因此,使用基于DNA/蛋白质序列机器学习的软件iMutant、MutaionTaster、VEST、EVE和REVEL的预测评分数据,对这些VUS的功能致病性进行分析。
研究结果
参与者的人口统计学和基因背景:
健康参与者的中位年龄为49.05岁(18-88岁),癌症患者的中位年龄为59.77岁(19-82岁)。在健康组和PDAC患者中未观察到性别偏差(表1)。
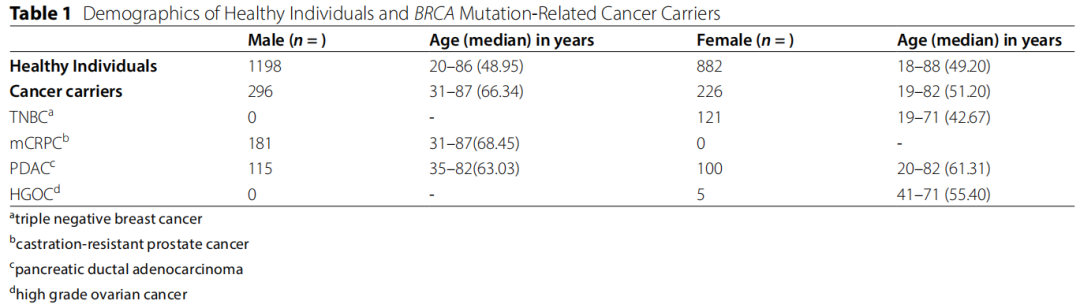
表1
在2080名看似健康的个体中,有十对自我报告的一级亲属。在522名癌症携带者中,有三对自我报告的一级亲属。健康组和癌症队列的地理分布情况如图1所示,健康个体来自中国34个行政区中的33个(除澳门特别行政区外),癌症患者来自其中25个地区。研究人群中的大多数来自大上海地区(健康组中,17.02%来自上海市,18.7%来自江苏省,12.99%来自浙江省;肿瘤患者中,34.99%来自上海市,21.03%来自江苏省,14.72%来自浙江省)。97.63%(1960/2020)的入组健康个体和98.45%(509/517)的癌症患者来自胡焕庸线以东地区,该地区覆盖了中国93%的人口。根据ChinaMAP的报告,我们还将参与者细分为七个不同的人群簇,包括西北汉族、北方汉族、东部汉族、中部汉族、东南汉族、南方汉族和岭南汉族(图1)。简而言之,本研究中人数最多的三个亚人群是东部汉族(健康个体中的56.40%和癌症患者中的77.20%)、北方汉族(健康个体中的21.92%和癌症患者中的9.77%)以及南方汉族(健康个体中的10.14%和癌症患者中的6.51%)。
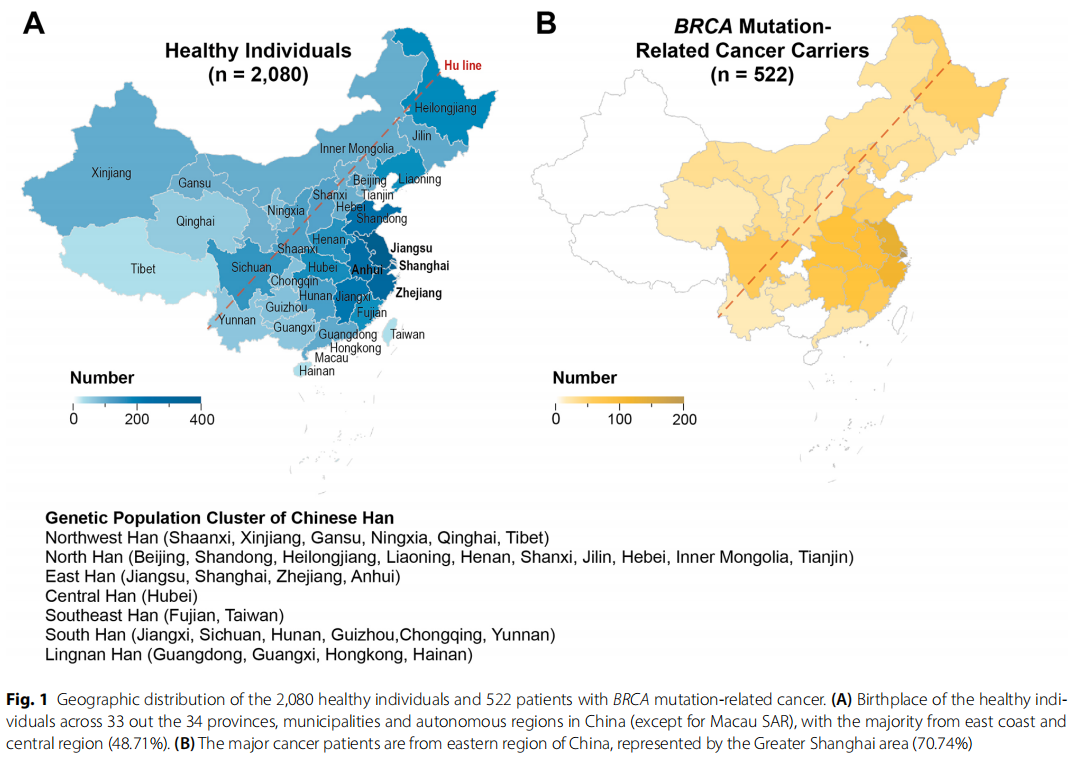
图1
中国汉族普通人群和BRCA突变相关癌症队列中的BRCA胚系变异:
研究者从2080名中国汉族健康个体和522名BRCA突变相关癌症患者中收集到了352个不同的胚系变异(BRCA1有127个,BRCA2有225个)。在这些变异中,211个是在健康个体中特异性鉴定出的,62个在癌症患者中鉴定出,而79个变异在两组中都存在(图2)。超过四分之一(134/352)的变异是反复出现的(携带者数量≥2)。其中,4个是PLP变异,29个是VUS,101个是良性/可能良性(BLB)变异,有51个是健康队列特异性变异,4个是癌症队列特异性变异。
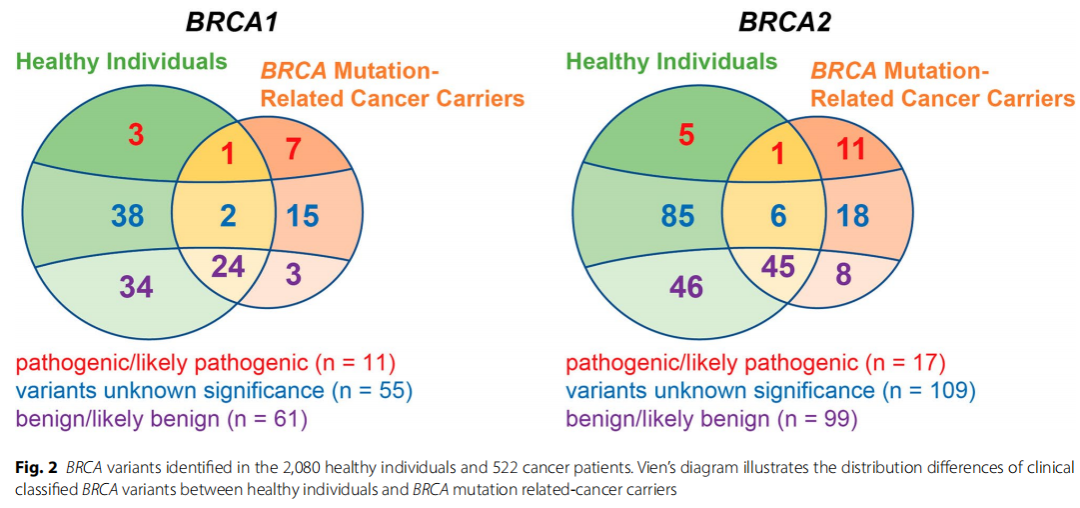
图2
平均而言,一名健康个体携带12.09个BRCA变异(BRCA1:4.80个,BRCA2:7.29个),一名癌症患者携带12.20个变异(BRCA1:4.97个,BRCA2:7.23个)。在健康组和癌症组之间,无论是BRCA1(P = 0.36)还是BRCA2(P = 0.52)的变异负荷均未观察到显著差异。在健康人群中,不同性别(P = 0.72)和不同年龄组(P = 0.85)之间的变异负荷也没有统计学显著差异。同时,高变异负荷也没有显著的区域或癌症类型聚集现象(P = 0.65)。这种在不同人口统计学和致病因素中BRCA变异负荷的同质性,表明了中国汉族人群中BRCA胚系变异存在一个统一且稳定的基线。
BRCA1/2致病性/可能致病性SNV和InDels:
在看似健康的个体中鉴定出10个PLP变异(表2),在癌症患者中鉴定出20个(表3)。在我们的中国汉族队列中,个体携带BRCA胚系PLP变异的概率为0.53%(11/2080)。在携带BRCA PLP变异的发生率方面,性别之间 [男性为0.33%(4/1198),女性为0.79%(7/882),P = 0.22] 和年龄组之间 [年龄小于60岁的为0.57%(10/1751),年龄大于等于60岁的为0.30%(1/329),P = 1.00] 均无显著差异。

表2
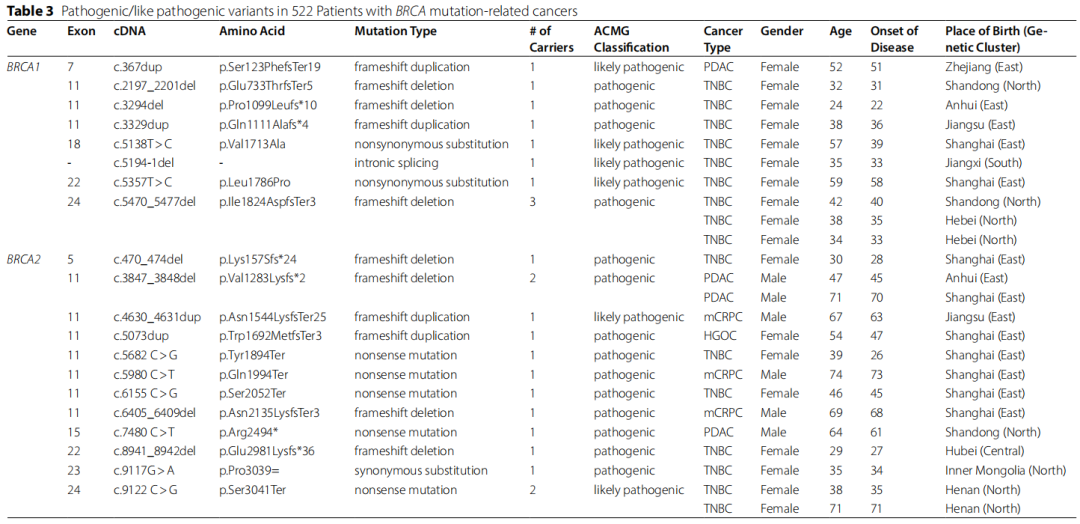
表3
健康个体特异性的8个PLP变异包括1个移码重复(BRCA2 c.7409dup)、4个移码缺失(BRCA1 c.869del,BRCA1 c.5521del,BRCA2 c.8650del,BRCA2 c.9753del)和3个无义变异(BRCA1 c.2934T > G,BRCA2 c.47 C > T,BRCA2 c.3599_3600del)。除了BRCA2 c.3599_3600del在1000基因组数据库或gnomAD数据库中有记录(在东亚人群中的频率为1.09×10⁻⁴ (1/9,197),在非芬兰欧洲人群中的频率为5.29×10⁻⁵ (3/56,761))外,这些变异在1000基因组数据库或gnomAD数据库中均未被观察到。此外,据研究者所知,BRCA1 c.869del、c.2934T > G、c.5521del以及BRCA2 c.3523 C > T、c.8650del、c.9753del在中国的任何普通人群筛查研究中均未被报道过。这8个变异在ClinVar、BIC、BRCA Exchange或LOVD数据库中均被报告为致病性变异,这表明在中国汉族普通人群中进行BRCA胚系突变筛查能够识别出携带有害变异的个体。
在健康个体和癌症患者中均鉴定出了两个无义变异,具体为BRCA1 c.5470_5477del和BRCA2 c.5682 C > G。值得注意的是,BRCA1 c.5470_5477del存在于5个无亲缘关系的个体中 —— 2名健康个体和3名TNBC患者,他们均来自中国北方省份(山东、河北、河南)。这个变异先前被报道为中国汉族乳腺癌患者中的一个始祖突变,在癌症患者 [北方汉族中为3/51,非北方汉族中为0/471,P = 8.84×10⁻⁴] 和健康个体 [北方汉族中为2/456,非北方汉族中为0/1624,P = 0.048] 中均显示出显著的北方汉族富集现象。BRCA2 c.5682 C > G在2个无亲缘关系的个体中被发现:1名健康个体和1名TNBC患者,他们均来自东部汉族(浙江和上海)。这个突变在gnomAD非芬兰欧洲人群中有记录,频率较低,为1.77×10⁻⁵ (1/56,574),在其他gnomAD人群或1000基因组中不存在。所有PLP变异的携带者均为杂合子。此外,反复出现的BRCA2 c.3847_3848del变异仅在来自东部(上海和安徽)的PDAC患者中被鉴定出。这个变异在先前针对东部和东南汉族的区域性研究中也有报道(浙江2769名未筛选乳腺癌患者中1例,上海316名前列腺癌患者中1例,澳门6314名正常人中1例)。
基因水平的变异流行率分析显示,在比较健康个体(BRCA1有4个,BRCA2有6个)和癌症患者(BRCA1有8个,BRCA2有12个)时,特定基因中PLP变异没有显著富集(Fisher精确检验P = 0.745)。在健康个体和肿瘤患者中,BRCA1和BRCA2基因结构(包括非翻译区(UTR)、内含子和外显子)中PLP变异的频率分布相似。然而,在癌症患者中,BRCA2的BRC重复区域(P = 0.019)和DNA结合结构域(P = 0.015)中PLP变异存在显著聚集,而在健康个体中,PLP变异则分散在各个功能结构域中(图3)。
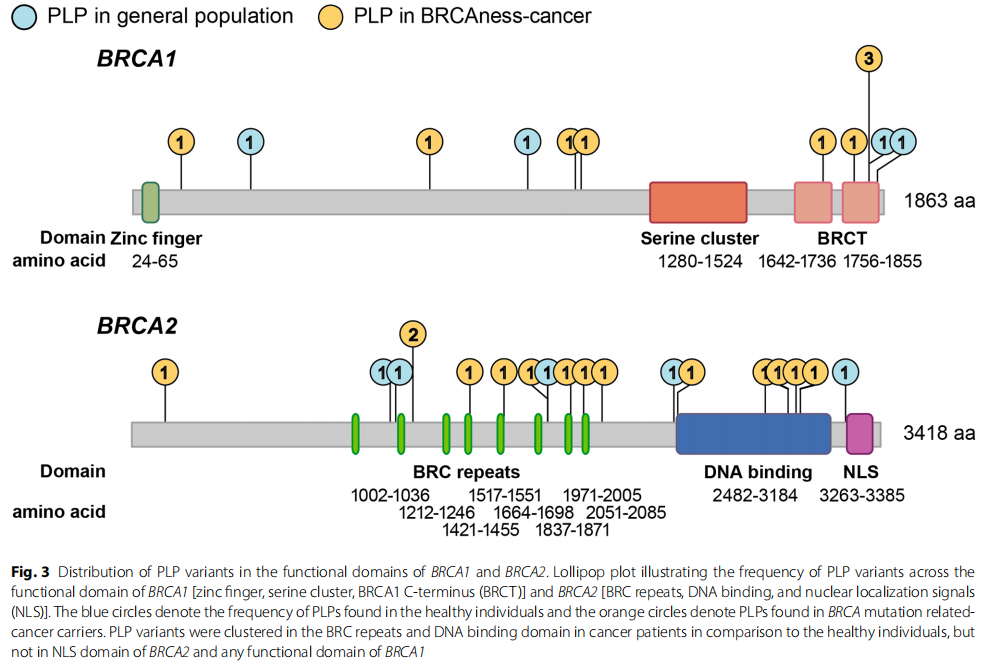
图3
从地理分布上看,研究者观察到在盐城市携带PLP变异的健康个体显著聚集,其流行率为3.39%(2/59)(Fischer精确检验,P = 0.039)。盐城市人口为669万,与中国其他城市相比,其BRCA变异的总负荷并没有显著更高,这导致了在中国东北沿海地区的这个城市中PLP变异出现了独特的地理聚集现象。研究者认为有必要对当地人群进行更广泛的筛查,以阐明基因因素与环境因素在癌症风险方面的相互作用。
反复出现的PLP变异携带者及随访期间癌症发病病例的案例研究:
在所有2080名正常个体中,研究者在2名独立个体中检测到了一个反复出现的致病性变异BRCA1 c. 5470-5477del:一名51岁女性和一名30岁女性。这个变异也在122名TNBC患者中的3名患者中被发现,具体为一名42岁女性、一名38岁女性和一名34岁女性。值得注意的是,携带BRCA1 c. 5470-5474del变异的51岁女性在BRCA变异筛查检测呈阳性16个月后的随访超声检查中,发现了双侧乳腺病变 [乳腺影像报告和数据系统(BI-RAD)4c级,左侧大小为7 mm × 4 mm,右侧为8 mm × 6 mm]。这些乳腺病变通过肿块切除术被手术切除,并经病理证实为局部浸润性导管癌(基底样型)。该患者在手术后未观察到其他癌症迹象。
此外,研究者鉴定出一名健康个体和一名TNBC患者共享BRCA2 c. 5682 C > G变异。在7个月的随访过程中,这名50岁的女性健康携带者没有出现任何临床表现,且癌症检查结果为阴性。
在看似健康的组中,一名携带BRCA2 c.3599_3600del无义变异的70岁男性在BRCA检测9个月后,被诊断出患有胰头钩突部PDAC,大小为36 mm × 34 mm × 21 mm。此外,一名携带BRCA2 c.3523 C > T变异的33岁女性在BRCA突变扫描后的第二次年度检查(10个月)时,被诊断出患有左侧乳腺浸润性黏液癌(大小为22 mm × 15 mm × 10 mm)。另外,研究者在两名无PLP变异的个体中发现了新的肿瘤。一个病例是一名59岁女性,在随访的第11个月被诊断出患有左侧乳腺TNBC(大小为24 mm × 15 mm × 15 mm);另一个病例是一名71岁男性,在随访的第24个月被诊断出患有胰体尾部PDAC(大小为33 mm × 32 mm × 27 mm)。
中国汉族普通人群和癌症队列中VUS的异同:
研究者还在中国汉族普通人群中鉴定出131个VUS,在癌症队列中鉴定出41个VUS。在2080名看似健康的个体中,研究者观察到20个反复出现的VUS。最常出现的VUS是BRCA1 c.2726 A > T,在来自中国南方主要地区的8名个体中被发现,包括上海(2名个体)、浙江(2名个体)、江苏(1名个体)、福建省(1名个体)和广东省(1名个体)。这个VUS也在一名患有PDAC的患者中被观察到,该患者是一名来自江苏省的71岁男性。
与健康组相比,癌症组在基因结构上没有显著的VUS富集现象,这与PLP变异在肿瘤组中剪接突变聚集的情况不同(P = 0.03)。根据ACGS分类标准,与健康个体相比,肿瘤患者中没有观察到高风险/中高风险变异的显著富集(Fischer精确检验,P = 0.96)。通过计算预测工具对VUS进行重新分类和评分也表明,根据当前的机器学习算法,包括iMutant(P = 0.12)、Mutation Taster(P = 0.20)、VEST(P = 0.81)、EVE(P = 0.50)和REVEL(P = 0.17),无PLP变异的肿瘤患者和看似健康的个体所携带的VUS没有显著差异。这表明应该对VUS的致病性进行更广泛的研究,例如,利用大规模的临床随访数据。
在癌症队列中,研究者在BRCA2中观察到两个反复出现的VUS:c.2186T > C(在一名来自浙江的69岁患有mCRPC的男性和一名来自上海的74岁患有PDAC的女性中发现)和c.8971 C > T(在一名来自河北省的28岁患有TNBC的女性和一名来自安徽省的52岁患有PDAC的男性中发现)。c. 2186T > C变异也出现在三名健康个体中(一名来自上海的76岁男性、一名来自黑龙江省的43岁男性和一名来自浙江的53岁男性),而c.8971 C > T仅在癌症病例中出现。值得注意的是,BRCA1 c. 3524 C > T是另一个在无PLP变异的61岁女性患者中观察到的癌症特异性VUS,该患者患有原发性PDAC和TNBC。研究者还在两名无亲缘关系的健康个体中鉴定出BRCA1 c.548-15G > A,先前有报道称该变异会诱导异常转录剪接。
中国汉族普通人群和BRCA突变相关癌症队列中的BRCA LGR:
除了SNV和InDels外,LGR是导致BRCA失活的另一个基因组因素。研究者使用NGS数据,在扩增子水平上全面分析了BRCA1和BRCA2中的CNV。经过MLPA试验,研究者证实了三名健康个体中存在LGR,包括两名携带BRCA2外显子22至外显子24缺失的亲属,以及一名携带BRCA2外显子12至外显子13重复的个体。有趣的是,研究者在522名癌症患者中未鉴定出任何BRCA LGR。这些证据表明,中国普通人群中存在BRCA LGR,尽管这些变异的致病性需要通过更长期的随访和更广泛的人群队列来进一步验证。
BRCA突变筛查识别出中国汉族普通人群中具有BRCA突变相关癌症风险的个体:
为了评估BRCA筛查是否能够有效地从普通人群中区分出具有BRCA突变相关癌症高风险的个体,研究者对看似健康组中1005名个体(11名BRCA PLP变异携带者和994名无BRCA PLP变异的个体)在BRCA突变检测后进行了前瞻性随访,以评估肿瘤风险。
在24个月的随访期间,研究者在11名BRCA PLP变异携带者中发现了3例新的BRCA突变相关癌症病例(包括2例TNBC病例和1例PDAC病例)。在994名无BRCA PLP变异的个体中,有2例新病例(1例TNBC和1例PDAC)。在性别分布方面 [PLP变异携带者中男性占36.36%(4/11),无PLP变异个体中男性占56.74%(564/994),P = 0.23]、年龄方面 [PLP变异携带者的年龄为42.91±13.03岁,无PLP变异个体的年龄为48.47±11.46岁,P = 0.11] 或随访持续时间方面 [PLP变异携带者的中位随访时间为10个月(第25至第75百分位数:7至20个月),无PLP变异个体的中位随访时间为16个月(第25至第75百分位数:10至19个月),P = 0.15],PLP变异携带者和无PLP变异个体之间均无统计学显著差异。因此,BRCA胚系突变检测呈阳性的个体患BRCA突变相关癌症的相对风险为135.55(95%CI 25.07-732.88),绝对风险增加了27.07%(95%CI = 23.24–30.90%)。
讨 论
BRCA胚系突变携带者面临着罹患BRCA突变相关癌症的高风险。虽然BRCA变异筛查能有效地帮助有乳腺癌/卵巢癌家族史的人群进行风险分类和预防,但BRCA变异的突变谱因种族而异,这引发了关于在全人群中开展筛查及其实施方式的争论。
先前的研究已经对中国人群中的BRCA胚系变异进行了探索,但仍存在一些尚未解决的挑战:(1)大多数研究都集中在已经被诊断患有BRCA突变相关癌症的患者身上;(2)针对健康个体的基于人群的研究存在地域限制(台湾、澳门、中国北方);(3)缺乏检测后的随访,以确定在普通人群中进行筛查是否能识别出高癌症风险个体。对于世界上最大的基因人群——中国汉族人群中BRCA胚系变异的功能情况,我们仍然了解不足。
本研究展示了研究者在BRCA胚系变异筛查方面的经验,涉及2080名看似健康的个体和522名BRCA突变相关癌症患者。研究覆盖了中国34个行政区中的33个(除澳门特别行政区外),为中国汉族人群提供了多样化的基因代表性。通过集中的招募、检测和随访流程,本研究流程确保了结论的一致性和可靠性。
研究者发现,中国汉族人携带BRCA胚系致病性或可能致病性变异的发生率为0.53%(1/189)。将本研究结果与中国先前的研究结果相结合,如Dong等人(0.53%,n = 11,386名中国正常人)、Qin等人(0.38%,n = 6,314名正常澳门人)、Chain等人(0.53%,n = 1,517名台湾人)、Liu等人(1.10%,n = 6,434名乳腺癌正常对照)、Lang等人(0.38%,n = 1,043名乳腺癌正常对照)以及Li等人(0.34%,n = 1,763名卵巢癌正常对照)的研究,研究者估计中国汉族人群中有害BRCA突变的发生率为0.52%(95%CI = 0.30–0.84%)。这一发生率低于德系犹太人中已确定的比率(2%),与美国和英国人群(0.5%)相似,略高于其他东亚人群,包括日本和韩国(0.2%)。中国不同研究中一致的变异频率强调了这一人群中BRCA胚系变异的稳定基线。然而,研究者也发现了突变谱存在显著的区域差异。例如,在本研究中,始祖突变BRCA1 c.5470_5477del 仅由北方汉族携带(健康个体中为0.44%,癌症患者中为5.89%),并且这一变异在先前中国南方地区进行的BRCA变异筛查研究中未被报道过。此外,研究者在健康组中发现的PLP变异,包括BRCA1 c.2934、c.5521del、c.869del以及BRCA2 c.3523 C > T、c.8650del、c.9753del,在先前对中国正常人群的筛查中也未被报道过。
值得注意的是,所有被鉴定出的PLP变异携带者在检测前的遗传咨询中都否认有癌症家族史,并且没有肿瘤的血清学或影像学指征。这些疏漏突显了基于家族病史的筛查策略的局限性:它要求必须有被诊断患有癌症的家庭成员以及详尽记录的家族疾病史。
健康个体和癌症患者的PLP变异突变谱存在差异。在本研究中鉴定出的11个BRCA1 PLP变异中,只有一个(c. 5470_5477del)在健康个体和癌症患者中都存在。同样,在17个BRCA2 PLP变异中,这两组也仅共享一个(c. 5682 C > G)。然而,健康个体中存在这些PLP变异并不否定它们的致病性。实际上,在携带这些PLP变异的11个人中,有3人在随访期间患上了BRCA突变相关癌症。例如,BRCA1 c.5470_5477del在北方汉族中具有相对较高的发生率(0.26%,3/1151),并且已显示出对三阴性乳腺癌的外显率。此外,应鼓励进一步努力对VUS的致病性进行分类,例如癌症队列中反复出现的BRCA2 c.8971 C > T变异,以及健康组中可能导致剪接异常的BRCA1 c.548-15G > A变异。长期的表型随访将提供超越当前机器学习方法的循证医学层面的见解。
与癌症患者中BRCA功能结构域(BRCA2的BRC重复区域和DNA结合区域)内PLP变异的聚集现象不同,研究者观察到健康个体中PLP变异在BRCA1和BRCA2序列中呈均匀分布。这支持了BRCA致病性变异在人类历史上相对较近时期才出现的假设;然而,进一步的疾病外显将变异的复杂性限制在了特定的基因组区域。这些发现突显了使用NGS进行BRCA胚系突变筛查的必要性。
除了SNV和小片段插入/缺失外,研究者在2080名健康个体中的3人身上观察到了两种类型的LGR。其中包括两名有亲属关系的个体,他们携带相同的BRCA2外显子22至外显子24缺失。值得注意的是,在522名癌症患者中未观察到LGR。到目前为止,这三名携带LGR的个体,即使在分别达到52岁、55岁和78岁的随访年龄时,也没有出现任何患恶性肿瘤的迹象。这解释了在中国BRCA突变相关癌症中LGR的相对较低外显率(约1%),与欧洲患者相比。然而,应鼓励进行超过24个月的长期随访,以阐明这些结构变异的致病性。这也突显了需要一种敏感且特异的算法,用于利用NGS数据检测LGR。
研究者对1005名中国汉族健康个体的随访表明,在考虑了年龄、性别和随访时长等潜在混杂因素后,BRCA变异检测呈阳性的个体患BRCA突变相关癌症的风险显著增加(RR = 135.55,95%CI 25.07-732.88)。虽然PLP变异携带者组相对较小的样本量可能会导致估计过高,但这突显了在中国汉族普通人群中进行BRCA突变筛查的价值。
越来越多的证据表明,基于人群的筛查是预防BRCA突变相关癌症的更好方法,因为基于家族病史的筛查会遗漏很大一部分携带BRCA变异的个体。考虑到在这种情况下相对较高的发生率和突变谱背景、中国主要人群中独特的“小家庭”结构,以及东亚地区普遍存在的“医疗污名化”文化,研究者建议开展更广泛的BRCA变异筛查,并提供详细全面的基因咨询服务。
本研究的一个局限性是随访期相对较短,这可能无法充分反映PLP变异携带者相较于无PLP变异个体患癌的相对风险。此外,由于随访是自愿参与而非强制的,BRCA突变筛查结果为无PLP变异的健康个体可能参与随访的意愿有限,导致本研究的随访率为50%。此外,尽管本研究纳入了2080名健康个体,但区域抽样偏差使本研究结果主要局限于东部汉族人群,并不能完全代表14亿中国汉族人群的情况。而且,虽然单中心设计增强了检测和随访数据的可比性,但它也引入了抽样偏差和其他意想不到的混杂因素。因此,鼓励开展多中心前瞻性研究,以阐明在中国汉族人群中基于人群的BRCA胚系变异筛查的医学益处。进一步开展成本效益研究,以理解变异筛查与经济支出之间的平衡,以及开展关于基因检测结果影响的社会心理研究,将有助于制定针对中国汉族人群的最佳筛查策略。
通过整合2080名看似健康个体的NGS数据,研究者描绘了中国汉族人群中BRCA胚系变异(包括SNV、小片段InDel和LGR)的基因图谱,特别关注了东部汉族亚人群。健康个体和癌症患者的突变谱存在显著差异。此外,研究者对健康组中的1005名个体进行了短期随访,证实了通过基于人群的筛查被确定为PLP变异携带者的个体,相较于无PLP变异的个体,患BRCA突变相关癌症的风险显著升高。
本研究强调了BRCA胚系变异筛查在中国汉族看似健康个体中进行风险分层和癌症早期检测的实用性。研究者主张开展多中心前瞻性研究,以评估在中国汉族人群中基于人群的BRCA胚系变异筛查相较于传统基于家族病史的筛查的医学益处。此外,研究者预期本研究,以及对基因检测结果的经济考量和社会心理影响的调查,将有助于制定针对中国汉族人群的最佳筛查策略。
参考文献:
Wu Z, Zhang Q, Jin Y, et al. Population-based BRCA germline mutation screening in the Han Chinese identifies individuals at risk of BRCA mutation-related cancer: experience from a clinical diagnostic center from greater Shanghai area. BMC Cancer. 2024;24(1):411. Published 2024 Apr 2. doi:10.1186/s12885-024-12089-w



