Cell Metab 上海交通大学医学院附属仁济医院卜军团队揭示远程肢体缺血适应通过细胞外囊泡介导的肌肉-肝脏交互改善肝脂肪代谢
时间:2025-03-28 12:08:57 热度:37.1℃ 作者:网络
代谢功能障碍相关脂肪性肝炎(MASH)是脂肪肝疾病的进展形式,伴随肝脏炎症、纤维化和细胞损伤,严重时可导致肝硬化和肝癌。目前,MASH的治疗手段有限,且缺乏特效药物。近年来,器官间交互作用在代谢疾病中的重要性逐渐被认识,而肌肉与肝脏之间的信号传递被认为是潜在的治疗靶点。远程肢体缺血适应(Remote Limb Ischemic Conditioning, RIC)是一种通过短暂肢体缺血实现远程器官保护的非侵入性疗法,已在心脑血管疾病中显示出显著效果。然而,RIC是否对代谢性疾病如MASH具有治疗作用尚不明确。
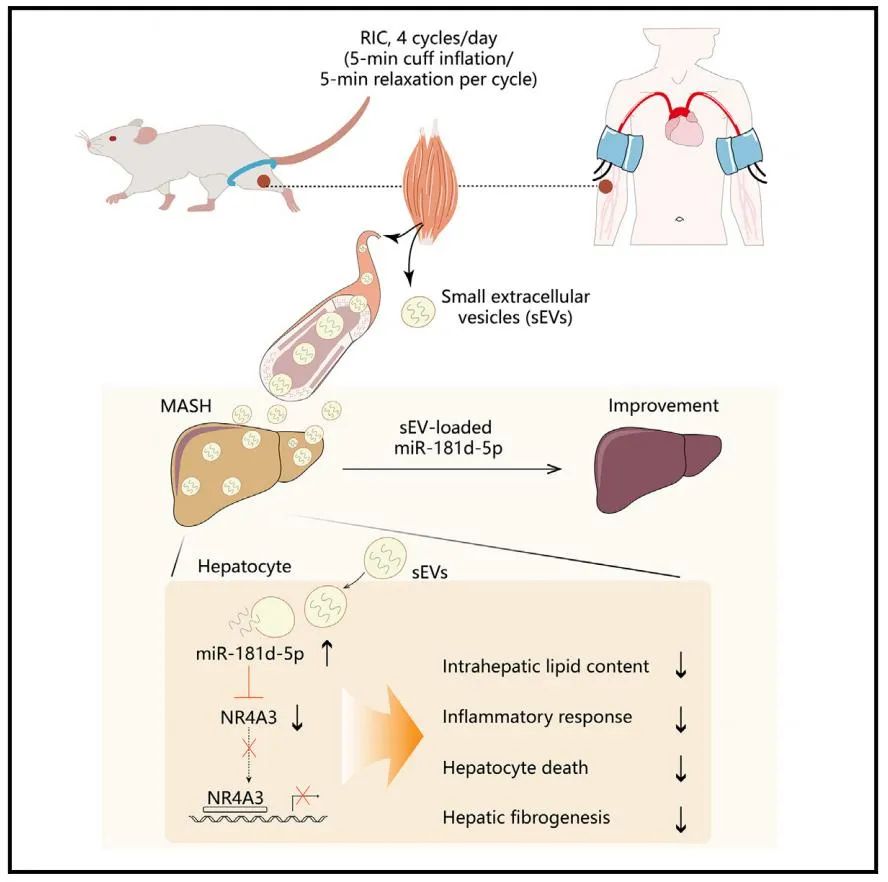
2025年3月18日,上海交通大学医学院附属仁济医院卜军教授团队在Cell Metabolism上发表了题为“Remote limb ischemic conditioning alleviates steatohepatitis via extracellular vesicle-mediated muscle-liver crosstalk”的研究论文,揭示了RIC疗法在改善MASH中的重要作用。研究首次阐明了RIC通过肌肉来源的小细胞外囊泡(sEVs)及其携带的miR-181d-5p,调控肝脏代谢和炎症反应的分子机制,为MASH的治疗提供了新的思路。

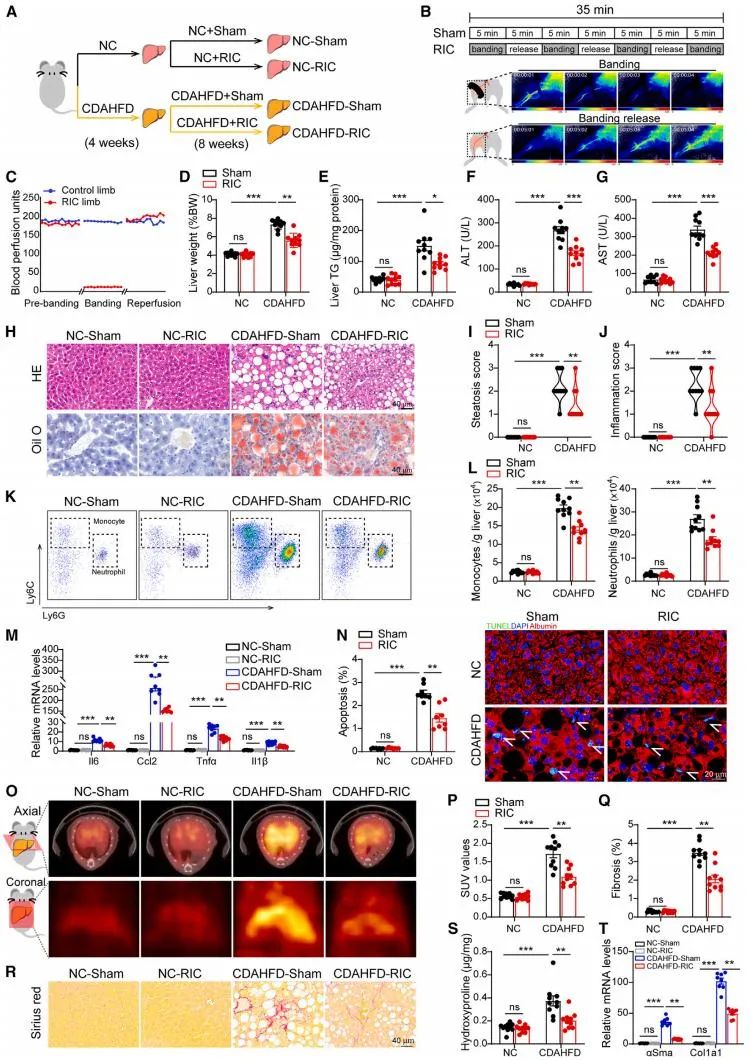
研究团队通过两种饮食诱导的MASH小鼠模型(CDAHFD和HFHC饮食)验证了RIC的治疗效果。实验设计为每天进行4个循环的肢体缺血(5分钟缺血/5分钟再灌注),持续8周。结果显示,RIC显著减轻了肝脏脂肪堆积、炎症浸润和纤维化,同时改善了肝功能指标(如ALT和AST水平)。RNA测序分析进一步表明,RIC上调了肝脏脂质代谢相关基因的表达,同时抑制了炎症、纤维化和细胞凋亡通路。
为了探究RIC的作用机制,研究人员通过联体共生实验(parabiosis)发现,RIC的保护效应可通过血液循环传递,提示其依赖于某种循环因子。进一步实验锁定肌肉来源的小细胞外囊泡(sEVs)为关键介质。RIC处理后,肌肉释放的sEVs通过血液循环进入肝脏,其中携带的miR-181d-5p在肝脏中显著富集。利用AVV过表达载体,研究人员证实,肝脏特异性过表达miR-181d-5p能够复制RIC的治疗效果,而抑制该miRNA则抵消了RIC的益处。
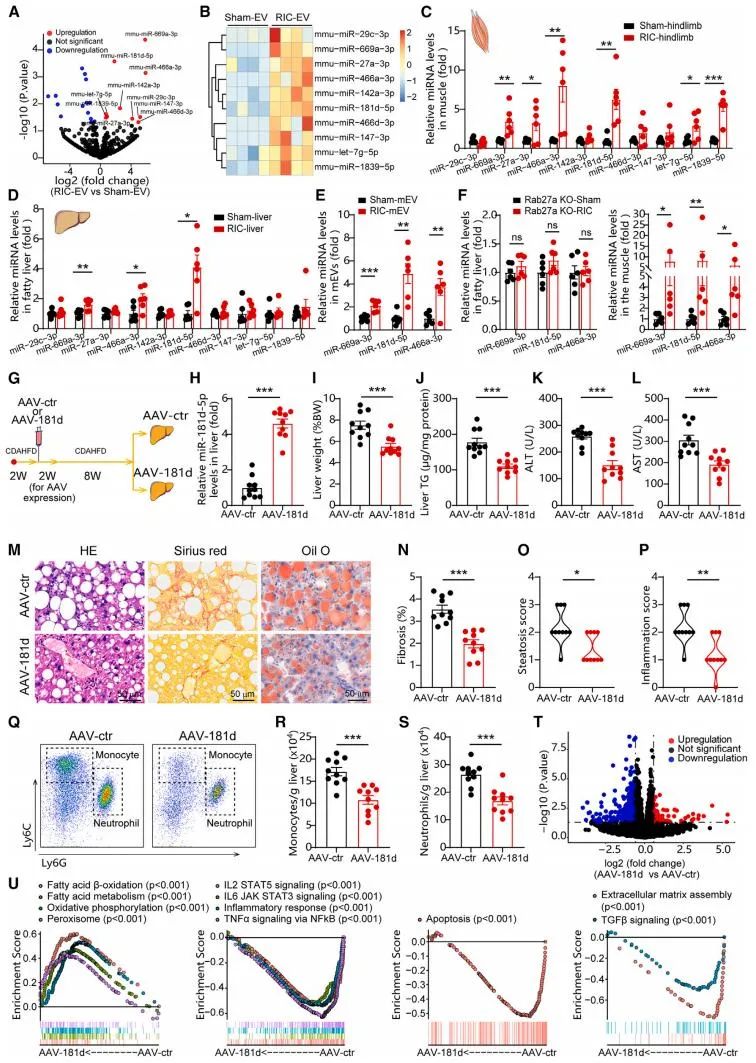
进一步机制研究发现,miR-181d-5p通过靶向抑制核受体NR4A3发挥治疗作用。NR4A3是一种转录因子,在MASH中表达升高,促进炎症和脂质堆积。研究团队构建了肝细胞特异性NR4A3敲除小鼠,发现其MASH表型显著改善,进一步验证了NR4A3在疾病中的负面作用。此外,RIC处理的人类志愿者血浆sEVs同样能够减轻MASH小鼠和原代人肝细胞的病理变化,凸显了其潜在的临床转化价值。

综上,本研究首次揭示了RIC在代谢性疾病中的治疗潜力,其非侵入性、安全性和低成本特点使其具有广泛的临床应用前景。RIC通过肌肉-肝脏交互作用调控miR-181d-5p/NR4A3轴,为MASH的精准治疗提供了新靶点。未来,基于sEVs或miR-181d-5p的疗法可能成为MASH的新型干预手段。
原文链接:
https://doi.org/10.1016/j.cmet.2025.02.009


