论著|脑小血管病MRI总负荷与老年高血压群体认知功能障碍的相关性分析
时间:2025-03-18 12:10:40 热度:37.1℃ 作者:网络
摘 要
目的 探讨老年高血压群体脑小血管病(cerebral small vessel disease,CSVD)MRI总负荷与认知功能障碍的相关性。
方法 纳入2018年1月至2024年9月于河北医科大学附属邢台市人民医院就诊的老年高血压患者,依据头颅MRI计算总负荷得分分为轻中度组(0~2分)和重度组(3~4分),比较两组一般资料和认知功能,分析MRI总负荷的危险因素及其与认知功能障碍的相关性。
结果 重度组收缩压[178(155,180) mmHg vs. 159.50(147.75,170) mmHg, P<0.05]、空腹血糖值[5.70(5.37,5.92) mmHg vs. 5.38(4.83,5.70) mmHg, P<0.05]和认知功能障碍比例[8(28.1%) vs. 3(6.8%), P<0.05]高于轻中度组;多因素logistic回归分析显示收缩压(OR=1.033,95%CI:1.001~1.067,P<0.05)是MRI总负荷的独立危险因素。Spearman相关分析显示MRI总负荷与MMSE得分(r= -0.315, P =0.011)、MoCA总分(r= -0.662, P<0.001)呈负相关。相比于轻中度组,重度组在MMSE量表的定向力、注意力和计算力、语言能力领域和在MoCA量表的视空间及执行能力、注意、语言、延迟回忆及定向领域表现差(P<0.05)。
结论 收缩压是老年高血压群体MRI总负荷的独立危险因素。MRI总负荷越重,认知功能障碍越重,可能在定向力、视空间及执行能力、注意力和计算力、语言、延迟回忆力表现较差。
关键词 脑小血管病;高血压;磁共振成像;MRI总负荷;认知功能障碍
脑小血管病(cerebral small vessel disease,CSVD)是有关脑穿通小动脉及分支、毛细血管和小静脉的临床、影像和病理综合征,起病隐匿,缓慢进展,是老年高血压群体认知功能障碍的常见病因[1-2]。其MRI特征[3]包括腔隙灶(lacunar infarction,LI)、脑白质高信号(white matter hypertensity,WMH)、脑微出血(cerebral microbleed,CMB)、血管周围间隙增大(enlarged perivascular spaces,EPVS)、脑皮质表面铁沉积和脑萎缩等。高血压在老年群体中发病率高且控制差,与CSVD进程关系密切。近年来针对CSVD MRI单一特征或总负荷与认知功能障碍相关性研究较多但结果不一[4-7],且针对老年高血压群体研究较少,因此本研究旨在评估 CSVD MRI总负荷对老年高血压群体认知功能的影响,为临床早识别、早干预提供证据。
1 对象与方法
1.1 研究对象 回顾性分析2018年1月至2024年9月就诊于河北医科大学附属邢台市人民医院的老年高血压患者临床资料。纳入标准:①年龄≥60岁,符合高血压诊断标准且病史>1年;②MRA或CTA证实颅内大血管未见狭窄或闭塞;③小学以上文化水平(受教育年限>5年)。排除标准:①合并糖尿病、高脂血症、严重心肝或肾功能不全、自身免疫性、代谢性及血液性疾病者;②其他脑部疾病、精神疾病患者及存在服用改善记忆药物者。共收集65例患者,其中男33例,女32例,年龄60~90岁,平均(66.63±7.01)岁。本研究已通过医院伦理委员会审批(2024-030),患者均知情同意。
1.2 研究方法
1.2.1 一般资料收集 收集资料包括年龄、性别、受教育年限、体质量指数(body mass index,BMI)、吸烟史、饮酒史、高血压家族史、收缩压、舒张压、脉压差、高血压病程年限(>10年)等基础资料,空腹血糖、甘油三酯、总胆固醇、低密度脂蛋白及高密度脂蛋白等检验结果。
1.2.2 CSVD MRI总负荷评分 患者MRI检查序列包括T1WI、T2WI、FLAIR、DWI和SWI。所有图像均由两名5年以上神经影像诊断经验的医师独立判读计算,若存在差异则二人协商决定。依据《中国脑小血管病诊治专家共识2021》推荐纳入的LI、WMH、CMB及EPVS四项指标,存在以下表现者分别记为1分:①≥1个LI;②深部WMH≥2分和(或)室旁WMH为3分;③≥1个深部或幕下CMB;④单侧基底节EPVS>10个(严重侧)。计算MRI总负荷得分(0~4分),将患者分为轻中度组(0~2分)和重度组(3~4分)[8]。
1.2.3 认知功能量表筛查与评估 采用简易精神状态检查表(Mini-Mental State Examination, MMSE)、蒙特利尔认知评估量表(Montreal Cognitive Assessment, MoCA)评估患者认知功能,记录总分及各项认知领域得分,MMSE总分为30分,<27分为认知功能障碍。若受教育年限≤12年,MoCA得分则加1分,满分不超过30分。
1.3 统计学方法 采用SPSS 26.0软件进行统计学分析。正态分布计量资料以x±s描述,组间比较采用独立样本t检验;偏态分布计量资料以中位数(下上四分位数)描述,组间比较采用Mann-Whitney U检验。计数资料以频数(百分比)描述,组间比较采用χ²检验。CSVD MRI总负荷危险因素采用多因素logistic回归分析。MRI总负荷分组与认知功能关系采用单因素logistic回归分析。MRI总负荷得分与MMSE、MoCA评分相关性采用Spearman等级相关性分析。检验水准α=0.05。
2 结果
2.1 一般资料 共纳入患者65例,其中MRI总负荷轻中度组44例,重度组21例。两组患者在性别、年龄、受教育年限、吸烟、饮酒、舒张压、脉压差、高血压病程、家族史、BMI及血脂四项差异均无统计学意义(P>0.05);重度组的收缩压(Z=-2.007,P=0.038)、空腹血糖(Z=-2.617,P<0.01)高于轻中度组。见表1。将单因素分析P<0.10的因素包括收缩压、空腹血糖、受教育年限(Z=-1.855,P=0.064)、BMI(t=1.923,P=0.059)纳入多因素logistic回归分析,结果显示收缩压(OR=1.033,95%CI:1.001~1.067,P<0.05)可能是MRI总负荷的独立危险因素。见表2。
表1 一般资料对比Tab.1 Comparison of general data
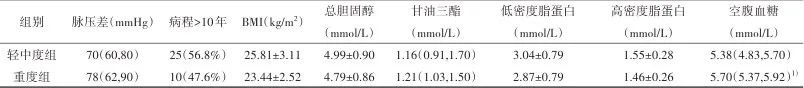
1)与轻中度组比较,经Mann-Whitney U检验,P<0.05。
表2 CSVD总负荷的危险因素分析Tab.2 Analysis of risk factor for CSVD total burden
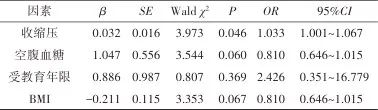
2.2 血压及认知功能 年龄为60~74岁共55人,收缩压为160(147,180) mmHg,舒张压为90(89,100) mmHg,脉压差为70(60,80) mmHg,MRI总负荷得分为2(1,3)分,MMSE总分为29(28,30)分,MoCA为26(24,27)分;年龄为75~84岁共8人,收缩压为167(152.25,179.50)mmHg,舒张压为83.5(80,98)mmHg,脉压差为77.50(70,87.50)mmHg,MRI总负荷得分为2(1,2.75)分,MMSE总分为28.50(26.50,30)分,MoCA总分为25.50(24.25,28)分;年龄≥85岁为2人,收缩压为170、164 mmHg,舒张压为74、102 mmHg,脉压差为96、62 mmHg,MRI总负荷得分为2、3分,MMSE总分为28、25分,MoCA总分为25、13分。
2.3 认知功能比较 当以MMSE量表为测量工具时,重度组认知功能障碍比例明显高于轻中度组(χ²=9.891,P=0.002)进行单因素logistic回归分析显示,MRI总负荷(OR=0.119,95%CI:0.027~0.515,P<0.05)对认知功能存在影响。重度组MMSE总分(Z=-1.335,P=0.021)低于轻度组;两组患者在记忆力及回忆力领域差异无统计学意义(P>0.05),在定向力(Z=-1.150,P=0.014)、注意力和计算力(Z=-2.069,P=0.042)、语言能力(Z=-3.746,P=0.003)领域差异有统计学意义。见表3。当以MoCA量表为测量工具时,重度组MoCA总分明显低于轻度组(Z=-3.903,P<0.001);两组患者在命名、抽象领域差异无统计学意义(P>0.05),在视执(Z=-2.703,P=0.001)、注意(Z=-2.291,P=0.039)、语言(Z=-3.205,P<0.001)、延迟回忆(Z=-2.904,P=0.002)及定向(Z=-0.994,P=0.011)领域差异有统计学意义。见表4。
表3 MMSE量表对比Tab.3 Comparison of MMSE scores

1)与轻中度组比较,经χ²检验,P<0.05;2)与轻中度组比较,经Mann-Whitney U检验,P<0.05。
表4 MoCA量表对比Tab.4 Comparison of MoCA scores

1)与轻中度组比较,经Mann-Whitney U检验,P<0.05。
2.4 MRI总负荷得分与认知功能得分的相关性分析 Spearman等级相关性分析显示,老年高血压人群MRI总负荷得分与MMSE总分(r=-0.315,P=0.011)、MoCA总分(r=-0.662,P<0.001)均呈负相关。
3 讨论
高血压相关CSVD即长期慢性高血压引起脑内穿支小动脉及分支硬化,血管壁炎症刺激内膜细胞增生、玻璃样变和纤维沉积,导致管壁增厚、管腔狭窄,引起脑实质慢性缺血或低灌注、血脑屏障破坏,出现缺血性白质病变、腔隙性梗死和脑萎缩,同时小血管破裂引发微出血及含铁血黄素沉积,最终引起认知功能障碍[1,9]。本研究发现收缩压可能是老年高血压群体MRI总负荷的独立危险因素,同时MRI总负荷重度组舒张压和脉压差水平高于轻中度组,但差异无统计学意义,这表明相比于舒张压,收缩压对CSVD脑损害影响更显著。目前研究[10-11]认为收缩压升高,增加血流脉动并阻碍血流进入小动脉形成血流障碍,对弹性差的血管壁形成冲击力并破坏自我调节机制,导致小血管内皮细胞死亡和紧密连接损伤,引发脑实质局灶性缺血或出血,导致CSVD发生。GAO等[12]也认为小血管壁的持续破坏和血脑屏障通透性增加推动了CSVD的发展。这提示临床医生在面对高血压相关CVSD患者时应重点控制好其收缩压水平。此外本研究发现MRI总负荷轻中度组高血压病程(>10年)比例高于重度组,差异无统计学意义,这初步表明高血压病程年限可能与CSVD脑损害严重程度无关,未来需大样本研究进一步证实。同时本研究在以年龄为界对老年高血压群体高血压程度、MRI总负荷及认知功能描述时,发现随年龄增大,存在收缩压升高、舒张压减低、脉压差增大、MRI总负荷加重、认知功能下降的趋势,提示机体老化可能影响患者血压及认知功能,契合国内流行病学研究[13]显示年龄和高血压是脑小血管病MRI总负荷的独立危险因素结果,但由于入组标准严格导致75岁以上病例数很少无法进行统计学分析,未来需在其他年龄段进一步观察。CSVD总负荷重度组空腹血糖水平较高,与既往关研究显示糖尿病与CSVD关系密切[14]相符,因此临床中同样应该重视血糖水平。
目前关于CVSD MRI特征与认知功能障碍研究[15-18]已揭示CMB位置、数目与整体认知功能障碍相关,并与特定区域如执行功能与处理速度方面减低存在关联;脑室旁及深部WMH与执行力、记忆力有关;存在EPVS患者认知功能障碍发生率明显升高等。高血压相关CVSD通常为多种MRI特征并存,MRI总负荷可全面评估其认知功能障碍,目前已成为研究热点。日本学者[19]通过对648例存在血管危险因素患者分析发现MRI总负荷得分与MoCA总分呈负相关,同时发现与注意力下降有关;国内学者研究[20-21]显示脑影像总负荷与认知功能障碍相关;但ZHU等[22]研究显示认知障碍与正常组间CSVD总负荷无差异。本研究结果显示MRI总负荷重度组认知功能障碍比例明显高于轻中度,总负荷得分与认知功能评分呈负相关,同时发现相比MRI负荷轻中度组,两种量表均显示重度组在定向力、注意力和计算力、语言能力方面表现差;此外MoCA显示重度组在视空间和执行功能方面表现差;虽然两组在记忆力方面无差异,但通过MoCA量表测试发现重度组延迟回忆力表现差,这也间接证明在认知功能评估方面,MoCA相比MMSE更加细致可靠。本研究优势在于入组标准把控严格,剔除了糖尿病、高脂血症等可以影响结果的数据,研究结果较为精确,但单中心和样本量相对较小是本研究的局限性。
综上,收缩压是老年高血压群体MRI总负荷的独立危险因素。MRI总负荷越重,认知功能障碍越重,在整体表现、定向力、视空间及执行能力、注意力和计算力、语言、延迟回忆力表现较差,未来需多中心、大样本研究进一步探究、分析。
参考文献:
1. LITAK J, MAZUREK M, KULESZA B, et al. Cerebral Small Vessel Disease[J]. Int J Mol Sci, 2020, 21(24): 9279.
2. ZLOKOVIC B V, GOTTESMAN R F, BERNSTEIN K E, et al. Vascular contributions to cognitive impairment and dementia (VCID): A report from the 2018 National Heart, Lung, and Blood Institute and National Institute of Neurological Disorders and Stroke Workshop[J]. Alzheimers Dement, 2020, 16(12): 1714-1733.
3. DUERING M, BIESSELS G J, BRODTMANN A, et al. Neuroimaging standards for research into small vessel disease-advances since 2013[J]. Lancet Neurol, 2023, 22(7): 602-618.
4. SHAO P, XU H, SHENG X, et al. Lobar Cerebral Microbleeds Are Associated With Cognitive Decline in Patients With Type 2 Diabetes Mellitus[J]. Front Neurol, 2022, 13: 843260.
5. SEKI M, YOSHIZAWA H, HOSOYA M, et al. Neuropsychological Profile of Early Cognitive Impairment in Cerebral Small Vessel Disease[J]. Cerebrovasc Dis, 2022, 51(5): 600-607.
6. PASSIAK B S, LIU D, KRESGE H A, et al. Perivascular spaces contribute to cognition beyond other small vessel disease markers[J]. Neurology, 2019, 92(12): e1309-e1321.
7. JOKINEN H, KOIKKALAINEN J, LAAKSO H M, et al. Global Burden of Small Vessel Disease-Related Brain Changes on MRI Predicts Cognitive and Functional Decline[J]. Stroke, 2020, 51(1): 170-178.
8. 张晓倩, 刘思睿, 范晓媛, 等. 不同脑小血管病影像学总负荷评分认知正常中老年人脑灰质体积的差异[J].中国医学影像技术, 2023, 39(1):12-16.
9. KAUL M, RUBINSTEIN I. Population-Based Magnetic Resonance Imaging: Earlier Detection of Hypertensive Cerebral Small Vessel Disease[J]. Hypertension, 2021, 78(2): 540-542.
10. CIOBANU D M, MIRCEA P A, BALA C, et al. Intercellular adhesion molecule-1 (ICAM-1) associates with 24-hour ambulatory blood pressure variability in type 2 diabetes and controls[J]. Cytokine, 2019, 116: 134-138.
11. LIANG M, XU S, LUO S, et al. Correlation between ambulatory blood pressure variability and vasodilator function in middle-aged normotensive individuals[J]. Blood Press Monit, 2017, 22(6): 355-363.
12. GAO Y, LI D, LIN J, et al. Cerebral small vessel disease: pathological mechanisms and potential therapeutic targets[J]. Front Aging Neurosci, 2022, 14: 961661.
13. YANG Y, CAI X, ZHOU M, et al. Prevalence and Risk Factors of Cerebral Small Vessel Disease from a Population-Based Cohort in China[J]. Neuroepidemiology, 2023, 57(6): 413-422.
14. 李果, 赵继巍, 曹靖玮, 等.脑小血管病及其所致认知障碍的危险因素研究进展[J].神经疾病与精神卫生, 2021, 21(12): 903-908.
15. NANNONI S, OHLMEIER L, BROWN R B, et al. Cognitive impact of cerebral microbleeds in patients with symptomatic small vessel disease[J]. Int J Stroke, 2022, 17(4): 415-424.
16. ETHERTON M R, FOTIADIS P, GIESE A K, et al. White Matter Hyperintensity Burden Is Associated With Hippocampal Subfield Volume in Stroke[J]. Front Neurol, 2020, 11: 588883.
17. MARKUS H S, DE L F E. Cerebral small vessel disease: Recent advances and future directions[J]. Int J Stroke, 2023, 18(1): 4-14.
18. CIPRIANO L, SARACINO D, OLIVA M, et al. Systematic Review on the Role of Lobar Cerebral Microbleeds in Cognition[J]. J Alzheimers Dis, 2022, 86(3): 1025-1035.
19. HOSOYA M, TOI S, SEKI M, et al. Association between total cerebral small vessel disease score and cognitive function in patients with vascular risk factors[J]. Hypertens Res, 2023, 46(5): 1326-1334.
20. LI X, YUAN J, QIN W, et al. Higher Total Cerebral Small Vessel Disease Burden Was Associated With Mild Cognitive Impairment and Overall Cognitive Dysfunction: A Propensity Score-Matched Case-Control Study[J]. Front Aging Neurosci, 2021, 13: 695732.
21. HUA M, MA A J, LIU Z Q, et al. Arteriolosclerosis CSVD: A common cause of dementia and stroke and its association with cognitive function and total MRI burden[J]. Front Aging Neurosci, 2023, 15: 1163349.
22. ZHU Z, ZENG Q, ZHANG R, et al. White Matter Free Water Outperforms Cerebral Small Vessel Disease Total Score in Predicting Cognitive Decline in Persons with Mild Cognitive Impairment[J]. J Alzheimers Dis, 2022, 86(2): 741-751.
【引用格式】李杰,贾林燚,高凤霄,等. 脑小血管病MRI总负荷与老年高血压群体认知功能障碍的相关性分析[J]. 中国神经精神疾病杂志,2025,51(1):15-19.
【Cite this article】LI J,JIA L Y,GAO F X, et al.Correlation between MRI burden of cerebral small vessel disease and cognitive impairment in elderly hypertensive people[J]. Chin J Nervous Mental Dis,2025,51(1):15-19.
DOI:10.3969/j.issn.1002-0152.2025.01.003


