特别关注|动力蛋白相关蛋白1(Drp1)在非酒精性脂肪性肝病中的作用
时间:2025-03-05 12:08:54 热度:37.1℃ 作者:网络
非酒精性脂肪性肝病(NAFLD)目前已成为全球最常见的肝脏疾病,估计影响全球38%的人口。由于NAFLD巨大且不断增长的治疗需求,相关发病机制及治疗研究受到极大关注。全球首款针对NAFLD的药物Resmetirom在美国已获得批准使用,但其长期疗效尚需进一步评价。深入探究NAFLD的发病机制,对于开发针对关键靶点的有效治疗药物仍有重要意义。目前研究认为NAFLD的病程演变包括肝损伤、脂肪性肝炎、肝纤维化和肝硬化,最终可导致肝细胞癌和严重的肝外并发症。大量研究表明,NAFLD的发病机制与线粒体功能障碍高度相关,线粒体是脂肪肝中脂质代谢的关键决定因素。而动力蛋白相关蛋白1(Drp1)是影响线粒体形态最重要的蛋白质之一,目前Drp1介导的线粒体分裂被认为是NAFLD中一个适应的过程,可加剧肝脏胰岛素抵抗、脂肪性肝炎和细胞死亡。NAFLD细胞内脂质积累可促进活性氧(ROS)的产生,从而影响线粒体功能并导致细胞毒性。相反,线粒体功能障碍又会打破肝脂肪合成与分解的稳态,进一步促使ROS的过量产生,形成恶性循环,加重NAFLD的进展。因此,线粒体处于融合和裂变的动态平衡中,而针对恢复线粒体动力学的靶向药物则成为NAFLD治疗的热点研究方向。
1线粒体在NAFLD中的作用
越来越多的证据表明,在肝细胞中线粒体可通过数量和功能的可塑性来适应各种外部刺激。而线粒体的可塑性是随着NAFLD的进展而丧失,且线粒体失调发生在NAFLD的早期阶段。肝脏是碳代谢(葡萄糖、脂质和蛋白质)发生调节的主要器官,而线粒体是肝脏代谢途径,特别是脂质代谢的重要细胞器。在NAFLD的病理发展过程中,脂质的合成和分解出现了失衡,其中脂质分解代谢主要依赖于线粒体脂肪酸β-氧化。在NAFLD中,受过氧化物酶体增殖物激活受体γ辅激活子1α调控的线粒体代谢被强烈抑制,导致线粒体氧化磷酸化、线粒体呼吸和β-氧化减少,从而促进脂肪积累并驱动疾病进展。线粒体是动态的细胞器,有规律的裂变和融合是维持其大小和形态所必需的。然而,在病理性NAFLD条件下,以Drp1为主要代表的调控蛋白表达失调。在胰岛素抵抗和脂肪肝患者中,线粒体中的脂肪氧化上调,以支持对腺苷三磷酸和氧化还原过程的需求增加,从而维持葡萄糖产量升高。NAFLD中线粒体功能的上调不仅使脂肪酸氧化升高,还增加了三羧酸循环的通量,后者提供碳中间体,为脂肪酸合成提供燃料。脂肪肝线粒体氧化功能的永久性增加导致线粒体ROS生成升高,部分学者认为这一过程通过诱导氧化损伤进而引发肝炎。因此,线粒体对这种增加的代谢负荷的失败或不适应可能是触发向非酒精性脂肪性肝炎过渡的关键事件。线粒体是细胞生存必不可少的细胞器,是细胞的“能量站”,为无数细胞过程产生必要的能量。线粒体是一种高度动态的细胞器,通过融合和裂变来调节其形态并控制线粒体的数量和大小,这一过程被称为“线粒体动力学”。过度的线粒体分裂增加ROS的产生和膜电位的破坏,导致细胞损伤或死亡。线粒体动力学过程受线粒体成形蛋白的调控,而Drp1作为主要的促裂变蛋白发挥着关键作用。Drp1活性受到细胞严格的控制,以适应细胞对线粒体动态平衡的需求。因此探究Drp1的结构及在NAFLD发生发展的过程中Drp1的功能至关重要。
2Drp1的结构与功能
Drp1是一种在细胞质中广泛存在的大型的GTPase蛋白,由4个结构域组成:高度保守的N端GTPase结构域、位于C端的GTPase效应域、可变结构域(也称为插入物B)和螺旋状中间结构域。在结构上,Drp1由位于被称为束信号元件的颈部区域的头部(GTPase结构域)、包含中间结构域和GTPase效应结构域的茎以及未表征的可变结构域组成。晶体结构上,可变结构域通过形成T型二聚体或四聚体并有效结合靶膜而发挥铰链作用。由于缺乏与脂质相互作用的同源结构域,Drp1只能与其受体相互作用产生功能性复合物,该复合物随后聚集成寡聚体并运输至裂变位点。迄今为止,已发现4种线粒体外膜(OMM)受体蛋白——线粒体分裂蛋白1(FIS1)、线粒体裂变因子(MFF)、49 kD线粒体动态蛋白(MiD49)以及MiD51在细胞质中招募Drp1至OMM进行裂变。FIS1是第一个被确定为Drp1招募者的外膜适配蛋白,其在OMM上产生低聚物,作为支架并通过2个四肽重复样基序与Drp1相互作用。MFF是Drp1线粒体募集的重要因素,并被证实在线粒体裂变过程中对Drp1的线粒体募集发挥重要作用。MiD49/51可影响Drp1/MFF的相互作用以及Drp1在线粒体上的积累。磷酸化是通过与无机磷酸盐反应或通过从另一有机磷酸盐转移磷酸盐使化合物磷酸化的过程。Drp1通过磷酸化在不同位点被激活,参与调节多种生理过程,包括维持细胞功能、调控线粒体代谢、促进线粒体碎片化和自噬、调节OMM渗透性以及参与细胞凋亡等(图1)。根据修饰位点的不同,Drp1的特异性结构既可以作为磷酸化的激活剂,也可作为磷酸化的抑制剂。Ser616和Ser637作为2个重要位点已被广泛研究,前者磷酸化促进线粒体分裂和Drp1在OMM的定位,而后者可被蛋白激酶A(PKA)磷酸化,并被钙依赖性磷酸酶去磷酸化,可能是减少线粒体分裂的失活步骤。因此,Ser616磷酸化因其促进与其他裂变蛋白的结合可能激活裂变,而Ser637磷酸化则可能是一个灭活步骤。最近研究表明,Drp1是控制线粒体分裂的关键蛋白,可通过促进内质网小管的形成,增加线粒体的相互作用。
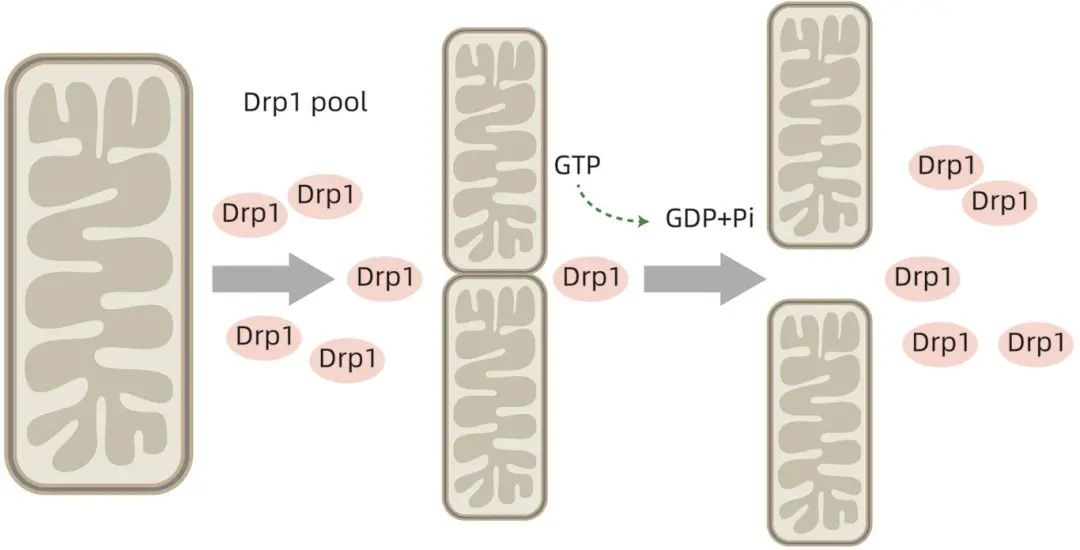
图1 Drp1经过磷酸化可引起线粒体分裂
3Drp1在NAFLD中的作用机制
大量研究表明,NAFLD的发病机制与线粒体功能障碍密切相关,线粒体的动态平衡对维持脂质代谢功能至关重要。在线粒体分裂过程中,Drp1的募集导致线粒体膜缩窄。有研究表明,通过抑制肝细胞Drp1活性,能够预防性地保护小鼠免受高脂饮食引起的肝脂肪变性、胰岛素抵抗和体质量增加。OMM上与Drp1结合启动线粒体断裂的MFF是神经酰胺下游的效应物,可促进胰岛素抵抗和单纯性肝脂肪变性。Drp1的人类同源基因DNM1L在脂肪组织中的表达与肥胖和胰岛素抵抗呈正相关,表明Drp1在代谢调节中发挥重要作用。
进一步研究揭示了Drp1在线粒体-内质网结构偶联中的关键功能。Drp1在线粒体-内质网结构偶联处组装成低聚物,包裹线粒体,然后低聚诱导GTP水解,改变低聚物的构象,切断线粒体。另有研究发现,Drp1塑造内质网小管,然后增加内质网-线粒体关联,促进线粒体分裂,但不依赖于寡聚化和GTP水解。此外,研究发现在内质网应激下,PKA介导Drp1的磷酸化,促进线粒体伸长,进而增强内质网-线粒体关联。进一步研究显示,小窝蛋白-1(细胞膜上的一种支架蛋白)上调抑制PKA依赖性的Drp1磷酸化,从而阻止线粒体延伸并减少内质网-线粒体关联。Drp1在OMM周围募集和激活,收缩和切断由FIS1、MFF和MiD49/50受体介导的线粒体。因此,Drp1在内质网-线粒体关联中发挥重要作用。靶向敲除Drp1可降低内质网应激,防止线粒体内膜蛋白激活和应激反应恶化以减轻NAFLD。RNA去甲基化酶介导Drp1 mRNA 3'UTR的N6-甲基腺嘌呤去甲基化,以YT521-B同源结构域家族蛋白1独立的方式诱导其翻译。随后,在转化生长因子β1诱导的肝细胞中,Drp1介导线粒体分裂,增加细胞增殖和迁移。Drp1表达降低抑制线粒体分裂,抑制肝细胞增殖和迁移。值得注意的是,纤维化的肝脏/心脏组织表现出增强的线粒体裂变,Drp1、α-平滑肌肌动蛋白、Ⅰ型胶原表达增加,N6-甲基腺嘌呤去甲基化酶AlkB同源蛋白5表达降低以及肝纤维化加重。去乙酰化酶家族在线粒体形态变化过程中也起着重要作用。有氧运动可激活沉默信息调节因子1(SIRT1),调控Drp1乙酰化,减轻NAFLD及其线粒体功能障碍。胰岛素抵抗在NAFLD的疾病发展中发挥重要作用,研究证实SIRT2能够降低Drp1改善胰岛素抵抗。
4Drp1的潜在作用靶点
鉴于Drp1在NAFLD病理机制中的关键作用,靶向Drp1的NAFLD治疗策略已成为研究热点。线粒体分裂抑制剂-1(Mdivi-1)是Drp1的一种特殊抑制剂,其对Drp1的化学抑制可极大阻碍线粒体分裂,并改善高脂饮食诱导的小鼠和人肝细胞中的脂滴沉积。此外,Mdivi-1可通过降低Drp1的激活和表达,减弱线粒体裂变,从而减少线粒体ROS积累和线粒体DNA损伤。总体而言,Mdivi-1可通过恢复线粒体稳态和功能,预防饮食诱导的NAFLD。薯蓣皂苷元是一种具有多种活性的膳食和植物化学甾体皂苷,研究发现其通过抑制Drp1缓解线粒体分裂和融合障碍,改善线粒体功能,延缓NAFLD进展。此外,薯蓣皂苷元还可提高超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性,下调ROS水平,增强抗氧化能力。有氧运动被证实通过激活SIRT1减轻NAFLD,但目前尚无针对SIRT1的靶向激活剂的相关研究,有待进一步探究。C-X-C基序趋化因子受体3(CXCR3)是慢性肝脏疾病中必不可少的促炎因子,敲除CXCR3的小鼠,其肝线粒体完整性可获得很大改善。与CXCR3纯合子小鼠相比,野生小鼠的线粒体功能明显受损,Drp1的表达明显增加。因此,靶向阻断CXCR3可改善线粒体功能障碍和脂肪性肝炎严重程度。另有研究证实,腺苷单磷酸活化蛋白激酶对体外肝脂肪变性具有保护作用,主要依赖于抑制Drp1介导的线粒体裂变。综上所述,通过调控Drp1及其相关通路的多种策略在NAFLD治疗中展现出潜在的益处。
5小结
在NAFLD的疾病进程中,线粒体的形态和功能变化扮演着至关重要的角色。Drp1在调控线粒体动力学平衡中发挥着重要作用,其通过影响内质网小管的形成促进线粒体的相互作用和分裂。此外,Drp1的磷酸化状态和去乙酰化也对线粒体形态和功能产生影响,从而影响NAFLD的病理状态。未来,针对Drp1的靶向治疗策略可能为NAFLD的治疗提供新的思路,进一步探究线粒体动力学及其调控机制是关键的研究方向。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50124



