论文解读丨山东大学刘奇迹教授团队:TMEM132E敲低可抑制三阴性乳腺癌肿瘤进展,并通过诱导ERα的再表达恢复对他莫昔芬的敏感性
时间:2025-01-15 12:14:32 热度:37.1℃ 作者:网络
三阴性乳腺癌(TNBC)是一种特殊的乳腺癌类型,其特征是不表达雌激素受体(ER)、孕激素受体(PR)及人类表皮生长因子受体2(HER2)。 尽管TNBC约占所有乳腺癌病例的15%,但其死亡率却高达50%。由于其高侵袭性,易转移和复发的特性,TNBC患者的预后往往较差。目前迫切需要能够预测TNBC转移潜力的生物标志物,这些标志物不仅能作为预后评估的关键指标,还可能成为潜在的治疗靶点。现有的乳腺癌内分泌疗法主要针对ERα和HER2阳性的患者,但不适用于TNBC患者。因此,TNBC患者主要依赖化疗,但化疗的副作用显著。在此背景下,探索在TNBC中重新表达ERα的可能性,从而使这类肿瘤对毒性较低的内分泌疗法变得敏感,成为一种有前景的治疗策略。这不仅有望为TNBC患者提供一种更为温和且有效的治疗选择,还可能为改善这一高危亚型的预后开辟新的途径。
跨膜蛋白家族132(TMEM132)是包含五个成员,编码单次I型跨膜蛋白。已有研究证实TMEM132家族中的TMEM132E与多种疾病密切相关,包括常染色体隐性非综合征型耳聋、精神疾病以及结肠直肠癌。此外,TMEM132E附近单核苷酸多态性(SNP)位点与绝经后采用激素治疗的女性罹患乳腺癌风险增加有关,推测其可能在乳腺癌发生发展的潜在作用。
山东大学基础医学院的刘奇迹教授团队在本刊发表题为“TMEM132E ablation suppresses tumor progression and restores tamoxifen sensitivity by inducing ERα expression in triple-negative breast cancer”的文章。该研究证实了TMEM132E在TNBC的发病机制中的重要作用,并揭示了TMEM132E在TNBC细胞中全新的调控机制。TMEM132E基因敲除与内分泌药物联合应用,对TNBC细胞产生显著的协同治疗效果。因此,TMEM132E有望成为TNBC的潜在诊断靶点或治疗靶点。
1、TMEM132E在TNBC中高表达
分析癌症基因组图谱(TCGA)的乳腺癌组织芯片数据集发现TMEM132E在TNBC和非TNBC组织中的表达均显著高于正常乳腺组织;与非TNBC相比,TNBC组织中TMEM132E的表达也显著升高(图1A)。免疫组化染色检测乳腺癌组织芯片中TMEM132E的表达也证实了这些结果(图1B)。免疫印迹分析也表明,TMEM132E在TNBC细胞(MDA-MB-231、MDA-MB-436和MDA-MB-468)中的表达高于正常乳腺细胞MCF10A和非TNBC细胞(T-47D和MCF7)(图1C)。
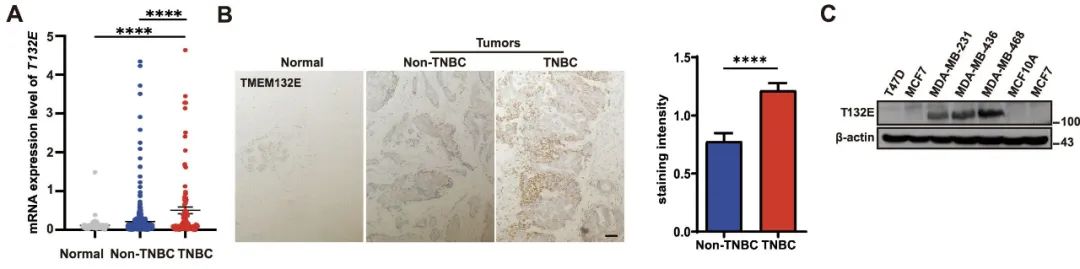
图1 TMEM132E在TNBC中高表达
2、TMEM132E敲低诱导ERα重新表达,从而恢复TNBC对他莫昔芬的敏感性
在上皮向间质转化(EMT)过程中,敲低TMEM132E会导致间质标记物的表达减少,同时诱导上皮标记物E-cadherin的表达增加(图1D)。
在TNBC细胞中, ERα基因通常因表观遗传机制而处于沉默状态。本研究中观察到敲低TMEM132E后,TNBC细胞中ERα的mRNA和蛋白水平显著升高(图1E、F)。随后,在TMEM132E敲低的TNBC组引入ERα拮抗剂他莫昔芬观察到,他莫昔芬在抑制TNBC细胞增殖、侵袭和迁移方面与TMEM132E敲低具有协同效应(图1G)为TNBC治疗提供了新的思路。
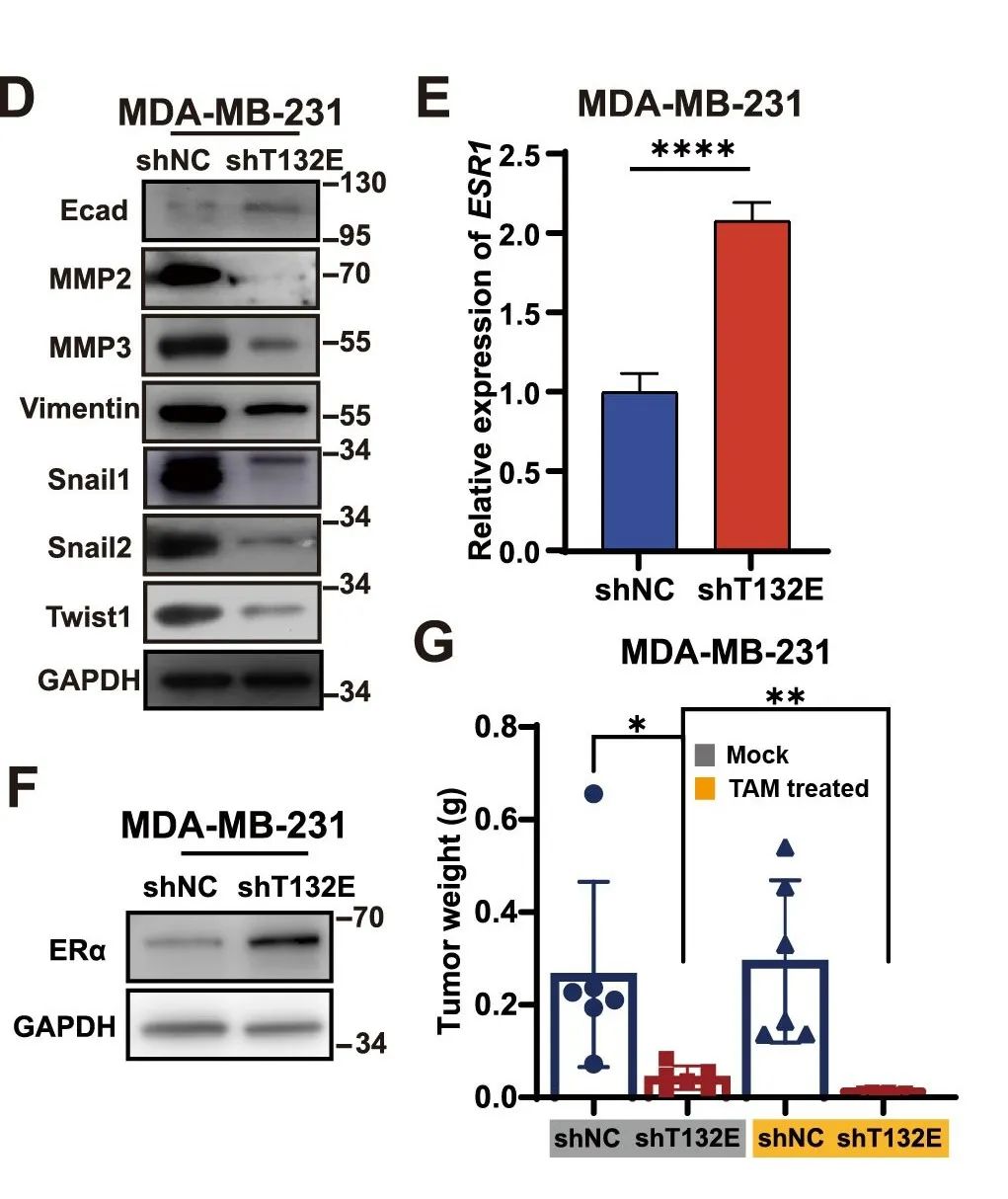
图2 TMEM132E敲低诱导ERα重新表达
3、TMEM132E敲低通过抑制TNBC中的PTEN/PI3K/AKT/CREB/CUL4B通路,实现ERα重新表达
转录组测序数据暗示PI3K/AKT通路可能参与了这一过程。实验结果表明,在TMEM132E敲低的TNBC细胞中, PI3K、PTEN、AKT和mTOR的磷酸化水平显著下降,而PTEN水平上升(图1H),表明TMEM132E敲低可能会抑制TNBC中异常激活的PTEN/PI3K/AKT/mTOR通路。cAMP反应元件结合蛋白(CREB)是PI3K/AKT的一个常见下游靶标,它能与Cullin 4B(CUL4B)基因启动子结合并正向调节其转录,而CUL4B可通过结合ERα启动子抑制ERα的表达。在本研究中,TMEM132E敲低的TNBC细胞中CREB的磷酸化水平及其下游的CUL4B表达水平下调,从而激活了ERα重新表达(图1I、J)。以上结果表明,TMEM132E沉默通过抑制TNBC细胞中的PTEN/PI3K/AKT通路和AKT/CREB/CUL4B通路诱导ERα再表达,从而抑制TNBC细胞的增殖、侵袭和EMT(图1K)。
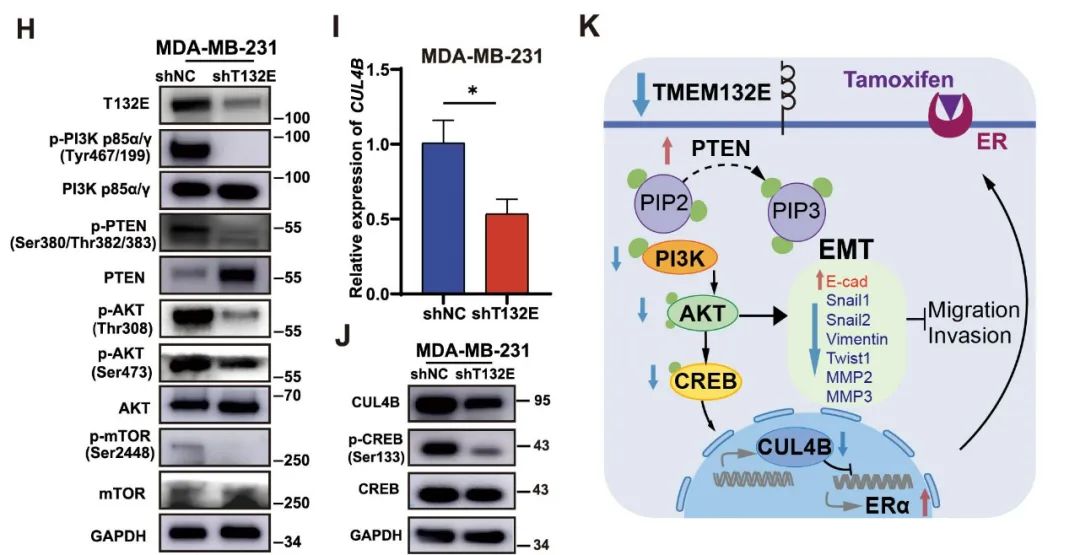
图3 ERα重新表达通过抑制PTEN/PI3K/AKT/CREB/CUL4B通路实现
4、总结
综上所述,TMEM132E在TNBC发展中起着重要的作用,其敲低后可抑制TNBC细胞的增殖、迁移、侵袭和EMT过程。此外,TMEM132E缺失会诱导ERα的再表达,将TMEM132E基因敲除与ERα拮抗剂结合使用可对TNBC细胞产生协同治疗效果。因此, TMEM132E被认为是一种很有前景的TNBC潜在诊断和/或治疗靶点。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304224001934
引用这篇文章:
Gao S, Sun P, Wang Z, et al. TMEM132E ablation suppresses tumor progression and restores tamoxifen sensitivity by inducing ERα expression in triple-negative breast cancer. Genes Dis. 2024;12(2):101396.


