【BioDrugs】改善CAR-T的疗效和安全性,小分子抑制剂大有可为
时间:2024-12-19 12:01:01 热度:37.1℃ 作者:网络
小分子抑制剂
CAR-T细胞疗法显著提高了B细胞恶性肿瘤患者的生存,但在其他血液肿瘤(如急性髓性白血病)和实体瘤中的疗效有限;主要障碍包括癌细胞上抗原表达的下调或缺失,靶细胞的可达性受限,以及高度免疫抑制的肿瘤微环境导致CAR-T细胞持久性较差。此外免疫疗法的制备也面临重大挑战,且患者经常出现副作用,如细胞因子释放综合征和免疫效应细胞相关神经毒性综合征。小分子抑制剂可以促进CAR-T细胞的制备,增强其抗肿瘤功效,并减轻其副作用,其中许多已经批准用于临床。使用肿瘤信号通路抑制剂来增强和改进CAR-T细胞治疗血液和实体瘤有较大的应用前景,联合策略可能会带来更有效的治疗,为耐药患者带来新的希望。
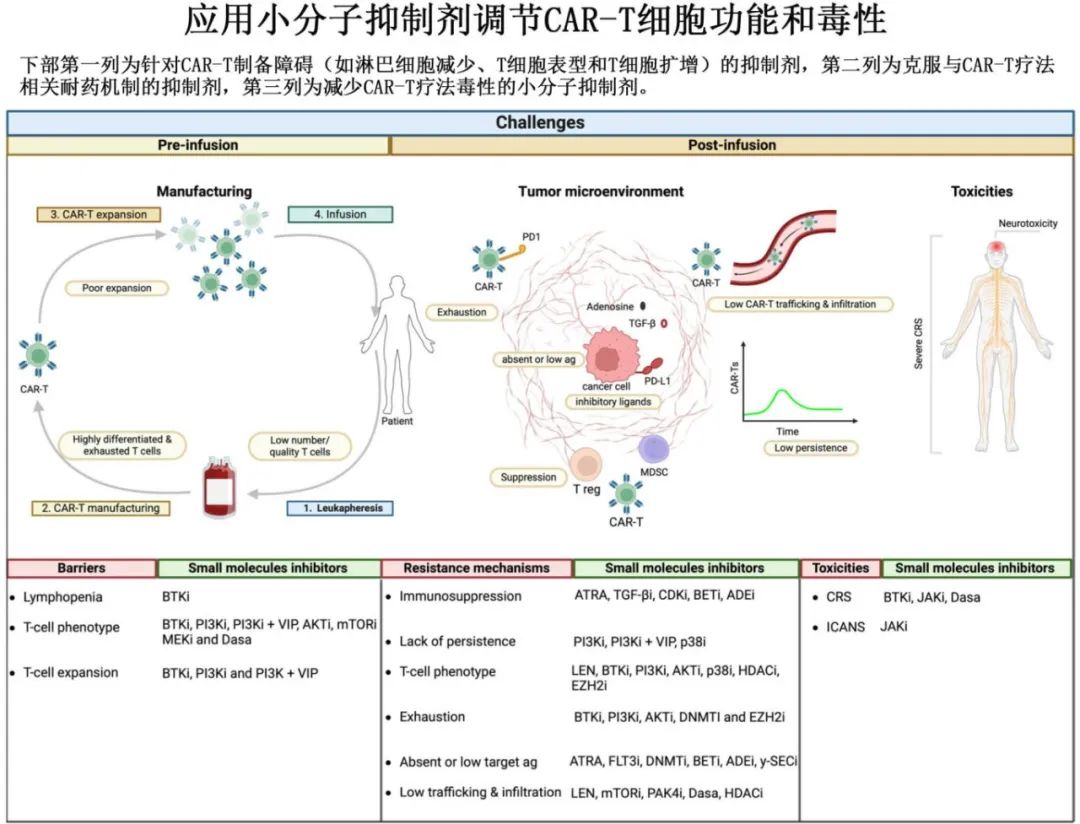
免疫调节剂
来那度胺具有增强CAR-T疗法的潜力,通过特异性靶向肿瘤细胞改变了肿瘤治疗。来那度胺通过调节多种生物通路增强CAR-T细胞功能,包括T细胞活化、效应细胞因子产生和免疫细胞分化;这些作用可以更好地根除血液肿瘤和实体肿瘤,解决CAR-T治疗的主要局限性之一,特别是在实体瘤中(肿瘤微环境通常会损害免疫反应)。此外,在临床环境中,来那度胺联合CAR-T疗法可改善总生存和肿瘤控制,并且增加的毒性较小,在恶性血液病如多发性骨髓瘤和淋巴瘤中尤为明显。来那度胺在胶质母细胞瘤和乳腺癌等实体瘤中也具有作用,为扩大CAR-T疗法在这些更难治的肿瘤中的应用开辟了新的可能性。
此外,免疫调节剂全反式维甲酸也可增强CAR-T细胞在血液肿瘤和实体瘤中的抗肿瘤作用。全反式维甲酸协同使用可作为有希望的策略,可以在更广泛的肿瘤范围内提高CAR-T疗法的持久性和有效性。
蛋白激酶抑制剂
多种蛋白激酶是致瘤性的关键驱动因素,制药行业已经开发出了许多蛋白激酶抑制剂,其中许多现已用于临床治疗肿瘤。除了对癌细胞的直接作用外,这些抑制剂还显著影响T细胞和树突状细胞的免疫功能,增强或抑制它们的免疫反应。
调控靶表达
多靶点酪氨酸激酶抑制剂可以增加部分CAR靶点和免疫激活配体的表面表达,从而增强CAR-T细胞在体内血液学和实体瘤异种移植模型中的抗肿瘤反应。应通过临床试验进一步研究,以评估其在肿瘤患者中的有效性和安全性。
抑制淋巴细胞特异性蛋白酪氨酸激酶(Lck)
根据临床前数据,达沙替尼在T细胞控制方面似乎是一个全能型药物。通过应用不同的剂量和治疗方案,达沙替尼可以通过防止耗竭来增强CAR-T细胞的功能,也可以减轻CAR-T相关副作用。达沙替尼具有已知的安全性和毒性,副作用主要与长期治疗相关。然而,数据从体外和体内转移到人体应用仍需要在临床试验中进行解决,特别是需要评估有效控制所需的最佳治疗方案和剂量,以保持后续CAR-T细胞的功能和效率。人们普遍担心,T细胞活性的完全关闭(如在治疗严重CRS期间)可能导致侵袭性肿瘤的不受控制的生长;因此,更具体地关闭单个CAR-T细胞功能可能比总体关闭更足以解决副作用。
BTK抑制剂
伊布替尼抑制BTK,可重置固有恶性肿瘤相关T细胞缺陷患者的T细胞表型。尽管临床数据很有希望,但潜在机制尚不完全清楚,因为BTK在不同T细胞亚群中的表达不同,且在活化T细胞和调节性T细胞(Tregs)中表达增加。因此还需要更多的研究来充分了解BTK抑制剂对CAR-T细胞疗效的影响。
PI3K‑AKT‑mTOR抑制剂
抑制PI3K-AKT-mTOR通路主要通过诱导分化程度较低的表型来增加T细胞的持久性和fitness。因此,组合方法主要集中在体外制备过程中的组合。因此副作用高度可控,因为抑制剂并非全身应用,从而增加了潜在的联合候选药物的数量。
MAPK(RAS‑RAF‑MEK‑ERK)通路抑制剂
MAPK抑制剂联合CAR-T治疗的研究仍处于早期临床前阶段,部分结果存在争议。值得注意的是,MAPK通路是一个普遍的通路,在多种健康组织中都有活性。因此在住院患者使用期间存在显著副作用的高风险,从而限制了住院患者应用的可能性。因此制备可以被特异性抑制的人工蛋白激酶可能是减少细胞信号意外关闭的一种选择。
JAK/STAT抑制剂
JAK/STAT通路在细胞因子与T细胞表面特异性受体结合后启动的信号级联反应中起主要作用,因此调节CAR-T细胞对邻近T细胞或其他免疫细胞分泌的细胞因子的反应是一个重要的参与者。通过阻断该通路可以调节CAR-T细胞的细胞因子诱导效应功能。部分JAK抑制剂(芦可替尼,itacitinib)对炎症性CAR相关副作用的管理有一定意义。
抑制TGF‑β诱导的信号通路
TME内产生的转化生长因子-β (TGF-β)可抑制实体瘤内的细胞免疫反应,因此屏蔽CAR-T细胞免受TGF-β的抑制作用或可增强CAR-T细胞功能。预防TGF-β信号传导可以通过不同的方式实现,例如通过敲除TGF-β受体链之一。
PAK抑制剂
p21活化蛋白是一个激酶家族,参与与细胞骨架重组、细胞运动、细胞周期调节和细胞凋亡相关的细胞过程。在T细胞中,PAK 1–4是CD3/CD28 T细胞激活的正调节因子,而PAK6的激活支持T细胞能量的维持。目前仅有PAK4抑制剂在CAR-T中研究。
DGK抑制剂
二酰基甘油激酶(DGK或DAGK)是一个由九个成员组成的家族。在TCR参与后,需要蛋白二酰基甘油来启动MAPK通路。DGK通过催化二酰基甘油转化为磷脂酸,减少可用DGK的数量,因此是抗原识别后T细胞活化的负调节因子。因此抑制DGK可导致TCR下游信号的增强和持续。
表观遗传调节因子
表观遗传学在基因调控和细胞过程中起着至关重要的作用,并经常参与肿瘤的发展。最近的研究也强调了表观遗传学在T细胞分化和衰竭中的重要性,对于产生有效的过继T细胞至关重要。靶向各种表观遗传调节因子的小分子,如DNA甲基转移酶、组蛋白去乙酰化酶(HDAC)、溴结构域和外端结构域(BET)蛋白、多梳子抑制复合物蛋白和环无关激酶,已证明可使肿瘤细胞对CAR-T细胞介导的杀伤敏感,或增强CAR-T细胞的适应性和抗肿瘤功效。将表观遗传调节剂与CAR-T疗法结合起来具有改善治疗结局的潜力。
DNA甲基化抑制剂
DNA甲基转移酶在各种肿瘤中经常上调,促进基因启动子的甲基化,导致转录抑制。阿扎胞苷可增强AML中CAR靶点的表面表达,特别是CD70和CD123,在体外研究和AML异种移植模型中都可提高CD70和CD123 CAR-T细胞的抗肿瘤功效。在CD123 CAR-T细胞研究中,发现阿扎胞苷预处理可降低CD123 CAR-T细胞中耗竭标志物CTLA4的表达,增强CAR-T细胞在AML模型中的疗效。
HDAC抑制剂
HDAC抑制剂是一种有效的抗癌疗法,可增强肿瘤抑制基因的表达。HDAC抑制剂panobinostat可改善CAR-T细胞浸润,促进中枢记忆T细胞表型,减少免疫抑制性Treg,显示出广泛的免疫调节作用。
CDK抑制剂
CDK7抑制剂THZ1在TNBC细胞中诱导与CAR-T治疗耐药相关的免疫抑制基因的最强转录抑制。THZ1在体外和皮下携带MDA-MB-231细胞的小鼠体内均增强EGFR CAR-T细胞的抗肿瘤功效。CDK7抑制剂可抑制免疫抵抗基因,增强实体瘤(如三阴性乳腺癌和胶质母细胞瘤)中的CAR-T功能。
BET抑制剂
BRD4是BET家族的一员,也调节免疫抑制基因的增强子和启动子,在体外和GBM异种移植模型中,BRD4与GBM细胞对EGFR CAR-T细胞的获得性耐药相关。BRD4抑制剂JQ1阻断免疫抑制基因的激活,增强EGFR CAR-T细胞在转移性GBM异种移植模型中的抗肿瘤作用。BET抑制剂可抑制免疫抵抗基因,增强实体瘤(如三阴性乳腺癌和胶质母细胞瘤)中的CAR-T功能。
EZH2抑制剂
ZH2抑制剂可改善CAR-T细胞多功能性和记忆表型,降低抑制性受体的表达并增强抗肿瘤活性。
细胞凋亡抑制剂
BCL2家族抑制剂
BCL-2家族抑制剂与CAR-T疗法联合使用在AML和CLL等血液肿瘤中显示出希望。虽然维奈克拉可以上调促凋亡蛋白和CAR-T靶点(如CD19),但直接共治疗会带来CAR-T细胞毒性的风险,降低CAR-T细胞数量,因此需要开发可抵抗维奈克拉的CAR-T细胞。
IAP拮抗剂
IAP拮抗剂如SMAC模拟物通过ripk1依赖机制促进细胞凋亡,是另一种有希望的方法。研究表明,将SMAC模拟物(如birinapant)与CAR-T细胞结合,可通过激活细胞死亡途径增强B细胞恶性肿瘤的抗肿瘤疗效。
γ-分泌酶抑制剂
γ-分泌酶是一种跨膜蛋白复合物,含有presenilin、nicastrin、Aph-1和Pen-2,足以维持γ-分泌酶的活性。γ-分泌酶抑制剂(GSIs)联合BCMA CAR-T细胞通过增加肿瘤细胞表面的靶抗原密度和减少可溶性抗原的数量来增强CAR-T治疗效果,显示出改善MM治疗结果的希望。
腺苷酸抑制剂
癌细胞产生的腺苷通过激活腺苷2A受体(A2AR)来抑制T细胞的抗肿瘤反应。用拮抗剂靶向A2AR可通过对抗腺苷介导的抑制增强CAR-T细胞抗肿瘤反应,并在与程序性细胞死亡蛋白1检查点抑制剂联合使用时协同提高疗效,尽管需要进一步的临床证据来验证其获益。
总结
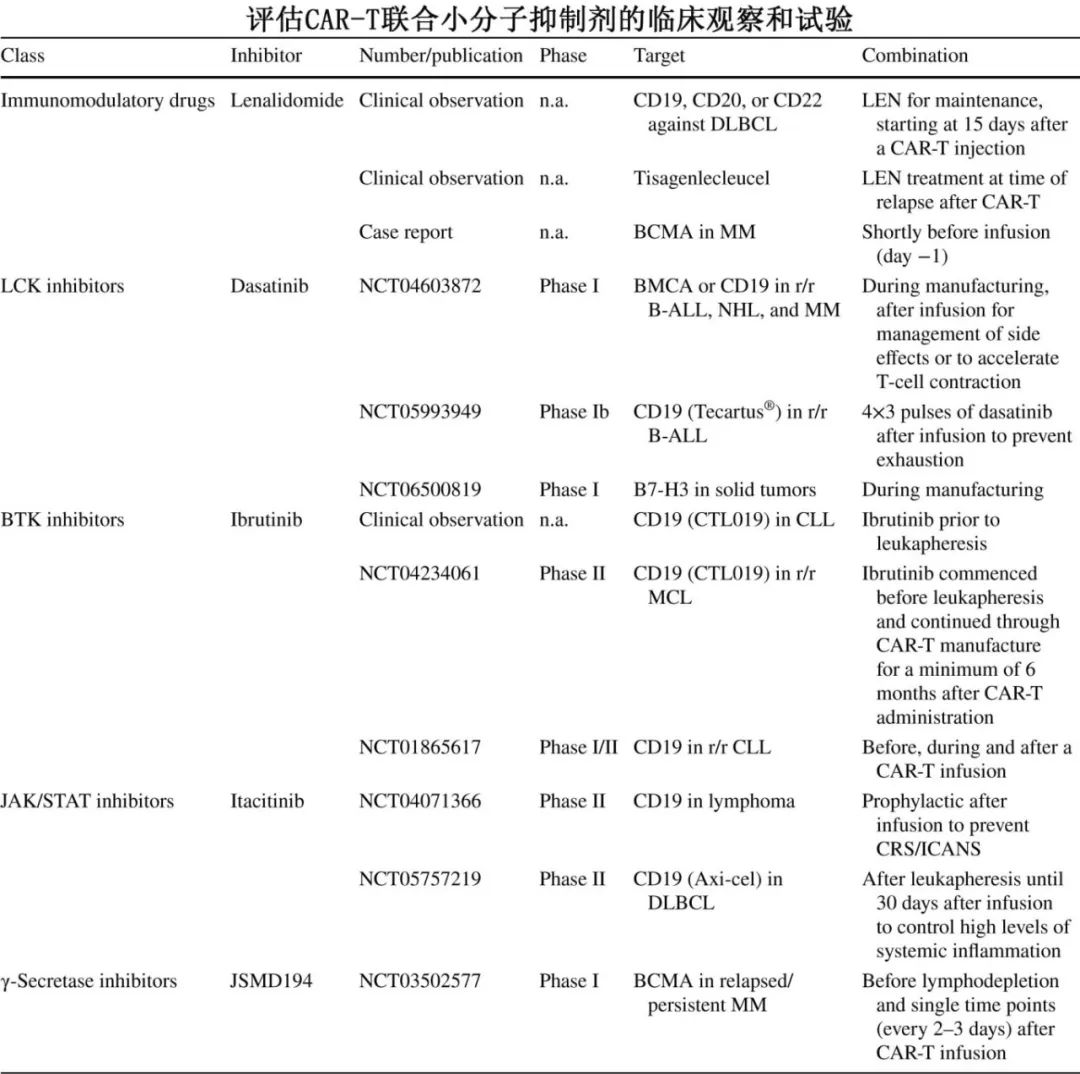
各种各样的小分子抑制剂家族正在解决CAR-T治疗在制备和输注过程中面临的挑战。下表概述了探索小分子抑制剂联合CAR-T疗法的临床观察和试验。大多数临床试验仍处于早期阶段,需要更广泛的临床试验来验证临床前观察结果。当然,联合方案还需要考虑费用问题。
参考文献
Mestermann K, et al. Accelerating CAR‑T Cell Therapies with Small‑Molecule Inhibitors.BioDrugs . 2024 Nov 26. doi: 10.1007/s40259-024-00688-9.


