为啥EGFR突变NSCLC耐药后还要持续做基因检测?RET融合和BRAF突变相继出现,指导联合用药
时间:2024-12-18 23:04:06 热度:37.1℃ 作者:网络
本病例报告描述了一例在使用奥希替尼和奥希替尼联合塞普替尼治疗后、观察到连续的获得性CCDC6-RET融合和BRAF V600E突变的EGFR突变非小细胞肺癌病例。通过连续液体活检、组织活检以及分子肿瘤委员会讨论,推动了耐药机制的发现。在确定CCDC6-RET融合后,患者接受了塞普替尼和奥希替尼联合治疗,长期获益且毒性可控。当在进展时检测到新的BRAF V600E突变时,分子肿瘤委员会建议给予三联疗法,添加曲美替尼(抗MEK抑制剂)。然而,治疗因毒性而停止,凸显了使用多种药物组合来解决复杂耐药性的挑战。
背 景
EGFR突变型非小细胞肺癌(NSCLC)患者从酪氨酸激酶抑制剂(TKI)靶向治疗中获益匪浅。然而,TKI的耐药会不可避免地发生,通常是由基因变异或表型转化等非基因组机制引起的。大约 20% 的EGFR突变型NSCLC病例会出现脱靶耐药,通常涉及基因扩增或MAPK激活或PI3K3通路的改变。本报告描述了一例EGFR突变型NSCLC患者的复杂病例,该患者出现连续CCDC6-RET融合和BRAF V600E突变作为耐药机制,并接受了个性化治疗。
病 例
患者女,69 岁,无吸烟史、无环境致癌物暴露史或严重合并症,于 2019 年确诊晚期肺腺癌(cT4N3M1c)。免疫组织化学显示TTF1阳性,P40、ALK和ROS1阴性,PD-L1表达率为 20%。使用研究人员机构内部DNA panel对诊断活检样本进行NGS测序,发现EGFR 19号外显子缺失(p.Glu746_Thr751delinsIleAla),从而使用奥希替尼进行一线治疗。患者获得部分缓解(根据RECIST标准,肿瘤缩小 40%)。30 个月后,患者淋巴结、肝脏、肺和骨骼出现疾病进展。液体活检(内部DNA panel)显示持续存在EGFR突变,变异等位基因频率(VAF)为 19.7%。随后使用卡铂和培美曲塞进行化疗,并持续使用奥希替尼,但效果不佳,第一次影像学评估疾病进展,VAF增加至 83.4%,表明存在EGFR扩增。开始使用紫杉醇和贝伐珠单抗联合奥希替尼进行三线治疗。然而,两个月后病情出现进展。对进展性肝病变进行活检排除了小细胞肺癌转化,使用内部DNA panel检测证实了EGFR扩增并确定了 CCDC6-RET 融合。随后患者接受卡博替尼、奥希替尼和吉西他滨治疗,但由于出现 3 级腹泻,该方案耐受性不佳,并在病情进展两个月后停药。使用FoundationOne panel进行了液体活检,证实了EGFR 19号外显子缺失(82.1%)、EGFR扩增和CCDC6-RET融合(6.7%)以及其它基因扩增,表明存在非整倍体基因型(图1)。分子肿瘤委员会建议联合使用奥希替尼(80 mg/天)和塞普替尼(RET抑制剂,80 mg/天)。尽管最初出现不良反应,包括 3 级中性粒细胞减少症、2 级水肿和 2 级高血压,但患者的病情显着改善,ECOG 体能状态从 3 提高到 1,与第一次影像学评估相比肝功能得到改善(图2)。联合治疗使疾病控制持续了 10 个月,直至肝脏出现进展。FoundationOne液体活检检测到新的BRAF V600E突变(2.3%),以及CCDC6-RET融合(1.4%)和EGFR变异。患者的治疗调整为奥希替尼(80 mg/天)、塞普替尼(80 mg/天)和MEK抑制剂曲美替尼(0.5 mg/天)。然而,患者的病情恶化,ECOG体能状态为 2、2 级下肢水肿、2 级腹泻和视力障碍,导致停止靶向治疗并开始使用卡铂和培美曲塞进行化疗。不幸的是,化疗耐受性差,病情在两个月内进展。患者转为姑息治疗并在首次确诊五年后去世。
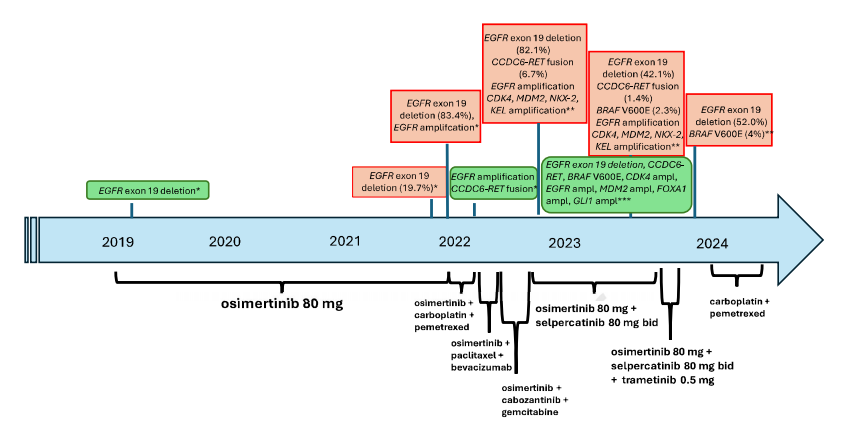

▲图1 通过组织和液体活检确定的分子变异,以及所实施的相应疗法的时间表
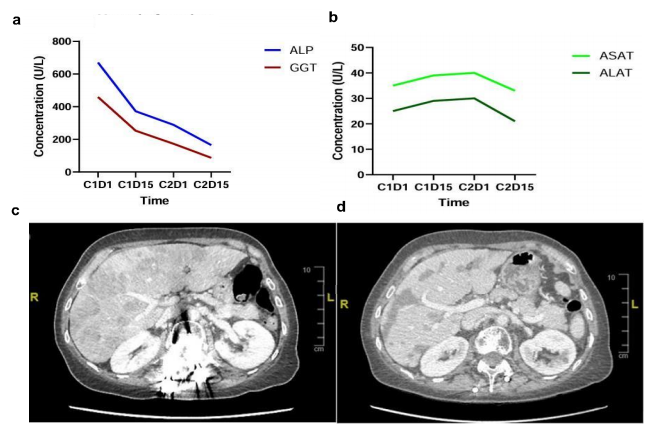

▲图2 肝功能和腹部CT显示的治疗反应
讨 论
在本病例报告中,一名患有晚期EGFR突变型NSCLC的患者在接受TKI治疗后病情进展,随后接受了一系列液体和组织活检,发现了两个获得性耐药变异。在靶向治疗中,脱靶耐药机制包括激活突变和基因扩增,最常见于MET和HER2,以及致癌融合,导致TKI单药治疗无效。根据耐药机制实施个性化治疗是暂时克服耐药的一种策略。EGFR和RET抑制剂的组合已显示出对奥希替尼进展后获得性RET融合患者有效。在本文病例中,疾病进展发生在使用塞普替尼和奥希替尼治疗 10 个月后,出现了获得性BRAF V600E突变。在Rotow等人的研究 6 例评估病例中,有一例通过液体活检检测到获得性BRAF V600E突变是联合治疗的耐药机制,但该患者未接受BRAF或MEK抑制剂联合治疗。此外,还报道了一例由RET和BRAF多克隆介导的奥希替尼耐药病例。对于获得性BRAF突变,临床前和临床证据支持联合使用EGFR和BRAF/MEK抑制剂的原理。尽管如此,尚未报道联合使用EGFR、RET和BRAF/MEK抑制剂的结果。由于细胞色素P450(CYP3A4)参与奥希替尼代谢,而塞普替尼是CYP3A4抑制剂,因此联合用药时奥希替尼水平可能会超过安全限度,从而增加与浓度相关的不良事件的风险。关于BRAF/MEK抑制剂,曲美替尼与其它TKI联合使用时比达拉非尼更安全,因为尚未证明其与CYP3A4有体内相互作用,而达拉非尼是CYP3A4诱导剂。在本文案例中,添加低剂量曲美替尼会显著影响治疗耐受性,导致停药。
联合使用靶向药物治疗复杂耐药性时,应考虑以下限制:①安全性:联合方案通常缺乏全面的安全性数据,需要密切监测;②疗效:主要驱动因素的可操作性量表可能不适用于耐药途径;③序贯策略:最佳药物顺序通常不清楚。在EGFR突变肺癌中,无论耐药类型如何,埃万妥单抗(amivantamab)或德帕瑞妥单抗(patritumab deruxtecan,HER3-Dxd)等药物在EGFR TKI进展后仍然有效(尽管这些药物当时还不能用于本文患者)。
总之,同时靶向主要驱动因素和旁路途径可能有效,但在存在多种变异或复杂耐药的情况下可能会失败。从安全性和有效性的角度来看,当耐药性由单一旁路机制驱动且没有多克隆耐药性证据时,研究人员主张同时靶向驱动因素和耐药变异。
参考文献:
Arianna Marinello, Claudia Parisi, Damien Vasseur, David Combarel, Juliette Bihoreau, Pernelle Lavaud, Rémy Ezzedine, Lodovica Zullo, Luc Friboulet, Gerard Zalcman, Antoine Italiano, Benjamin Besse, Mihaela Aldea,Personalized Therapy in a Patient with EGFR-Mutated NSCLC Developing Sequential CCDC6-RET Fusion and BRAF V600E Mutation as Bypass Resistance Mechanisms.https://doi.org/10.1016/j.jtocrr.2024.100773.



