Nature Medicine:MASLD和心血管风险有何联系?六大聚类带来的全新视角
时间:2024-12-13 06:00:32 热度:37.1℃ 作者:网络
引言
在过去的几十年里,脂肪肝从一种被广泛忽视的疾病状态逐渐成为全球健康的重大威胁,尤其是在代谢性功能障碍相关脂肪性肝病(MASLD)的研究领域。这种疾病不仅仅是肝脏脂肪堆积的简单表现,而是一种复杂的代谢紊乱,其发展可能伴随严重的并发症,如肝纤维化、肝硬化甚至肝细胞癌(HCC)。更令人担忧的是,MASLD通常与心血管疾病和2型糖尿病密切相关,进一步加剧了患者的健康风险。然而,MASLD患者的临床表现与疾病进展并不完全一致。有人可能在轻度代谢异常的状态下维持健康,而另一些人则可能快速恶化并面临多重并发症。为何会出现如此显著的个体差异?答案可能隐藏在这一疾病的异质性之中。
在这一背景下,研究人员通过不同的数据分析方法,例如聚类分析,从复杂的数据中提取模式,揭示MASLD的不同亚型。这些亚型不仅在临床表现和代谢特征上各具特色,还可能蕴含着不同的病理机制,为个体化治疗提供了全新的机会。12月9日Nature Medicine的研究报道“Data-driven cluster analysis identifies distinct types of metabolic dysfunction-associated steatotic liver disease”通过对MASLD患者的大规模数据分析,系统性地发现并验证了两种主要的MASLD亚型:心脏代谢型和肝特异型。研究表明,这些亚型在基因组、代谢组学特征以及长期临床结局上存在显著差异。
通过识别不同的亚型,医生可以更有效地制定针对性的治疗策略,避免“一刀切”的治疗方案可能带来的局限性。此外,聚类分析模型的应用表明,六个简单的临床变量(如HbA1c、ALT、甘油三酯等)即可高效区分不同风险组,显著提高了临床诊断的效率和精准度。该研究不仅揭示了MASLD的复杂性,还为如何应对这一复杂性提供了切实可行的解决方案。

代谢性功能障碍相关脂肪性肝病(MASLD,Metabolic Dysfunction-Associated Steatotic Liver Disease)是全球最常见的慢性肝病之一,影响了全球约30%的人口。这种疾病并非仅仅是肝脏脂肪堆积的结果,它包含一个广泛的病理谱系,从单纯性脂肪肝(steatosis)到代谢性功能障碍相关脂肪性肝炎(MASH,Metabolic Dysfunction-Associated Steatohepatitis),并可能进一步进展为肝纤维化、肝硬化甚至肝细胞癌(HCC)。
MASLD的复杂性不仅表现在其病理谱系上,还体现在其显著的个体差异性。例如,尽管一些患者仅表现出轻微的代谢异常,但另一些患者可能同时伴有显著的心血管疾病风险或糖代谢紊乱。通过对这一疾病进行更为精细的分层和分析,可以帮助更好地理解其异质性,并推动个性化治疗策略的开发。
近年来,数据驱动的分析方法,例如聚类分析,已经成为解决MASLD异质性问题的关键工具。该研究通过基于六个核心临床变量的聚类分析,揭示了MASLD的两种主要亚型,并探讨了其生物学机制及临床意义。
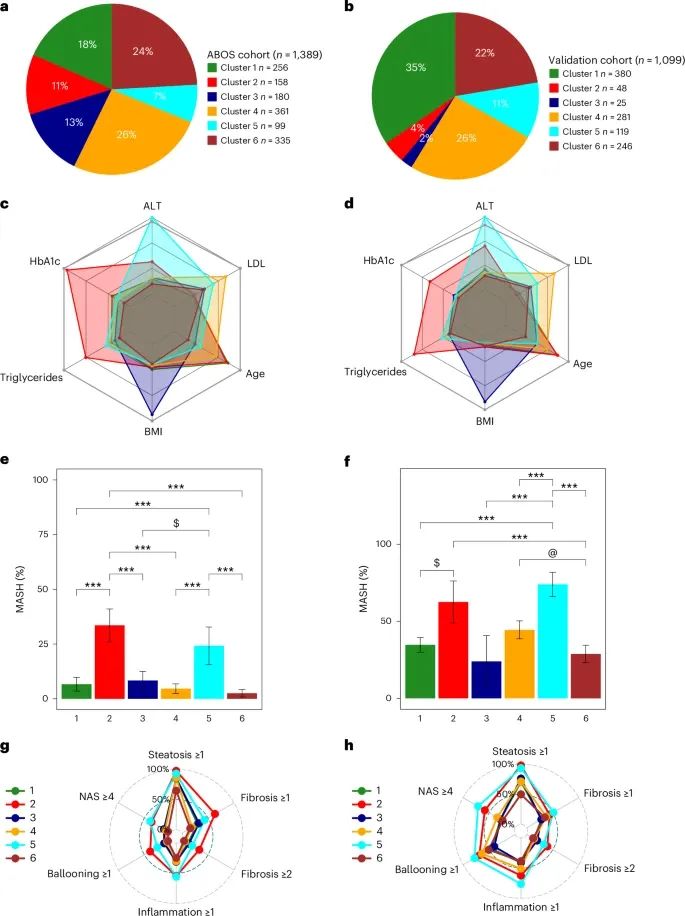
六个数据驱动聚类在临床和组织学指标上的差异(Credit: Nature Medicine)
数据驱动聚类的分布:
图a和b展示了在ABOS队列(n=1,389)和验证队列(n=1,099)中六个聚类的分布情况。ABOS队列显示了各聚类的比例,其中Cluster 4占比最大,Cluster 5占比最小,而验证队列总体趋势与ABOS队列相似,但Cluster 6的占比略有增加。
雷达图中的临床变量比较:
图c和d以雷达图的形式分别展示了ABOS队列和验证队列中每个聚类的六个关键变量(年龄、BMI、HbA1c、LDL、甘油三酯和ALT)的中位值。灰色线表示ABOS队列中95百分位值,用以标记极端高值的范围。不同聚类的变量值分布显著不同,例如Cluster 4的BMI和甘油三酯值较高,而Cluster 5在ALT指标上表现突出。
MASH患者比例:
图e和f以柱状图展示了ABOS队列和验证队列中每个聚类MASH(代谢性功能障碍相关脂肪性肝炎)患者的比例。统计分析表明,不同聚类的MASH比例显著不同,Cluster 5在两队列中均呈现最高的MASH比例,这与其较高的ALT水平相一致。
组织学评分雷达图:
图g和h展示了组织学评分的雷达图,包括NAS评分(≥4)、脂肪变性(steatosis ≥1)、小叶炎症(lobular inflammation ≥1)、气球样变(ballooning ≥1)、以及纤维化分期(fibrosis ≥1和≥2)。这些结果进一步显示了各聚类在肝脏病理特征上的显著差异。例如,Cluster 5在多项指标上表现出最高的病理评分,而Cluster 1的评分则较低。
数据驱动的MASLD亚型分类
该研究基于法国ABOS队列(n=1,389),结合比利时(UZA, n=463)、意大利(MAFALDA, n=261)和芬兰(Helsinki, n=375)三个独立验证队列的数据,采用非监督聚类方法对MASLD患者进行分类。聚类分析基于六个关键临床变量:年龄、BMI、HbA1c、ALT、LDL和甘油三酯。选择这些变量是因为它们能够反映代谢功能和肝脏健康的核心特征,同时具备易于测量的优势。
研究发现,这六个变量能够将MASLD患者分为六个聚类,其中两个亚型显示出高度独特的代谢和临床特征。
心脏代谢型(Cluster 2)
该亚型的患者心血管疾病风险显著升高(HR=1.80, P<0.001);同时,这一亚型的2型糖尿病发病率也显著增加(HR=6.82, P<0.001);糖化血红蛋白(HbA1c)水平显著升高(9.2%,对照组为5.7%,P<0.001)。甘油三酯浓度显著增加(2.34 mmol/L,对照组为1.32 mmol/L,P<0.001)。高血压比例高达87.3%(对照组为54.5%,P<0.001)。
肝特异型(Cluster 5)
这一亚型更倾向于进展为慢性肝病(HR=4.52, P<0.001);与心脏代谢型不同,其心血管风险变化不显著(HR=1.18, P=0.054);丙氨酸转氨酶(ALT)显著升高(75 U/L,对照组为24 U/L,P<0.001);严重纤维化(≥3级)的发生率显著增加(15.8%,对照组为3.4%,P<0.001)。
验证队列的结果与ABOS队列一致,进一步支持了这些聚类的稳健性。值得注意的是,心脏代谢型和肝特异型的比例在验证队列中分别为11%和9%。
生物学机制的差异化特征
通过对基因组和代谢组的进一步分析,研究揭示了心脏代谢型和肝特异型MASLD在分子机制上的显著差异。
肝特异型(Cluster 5)
胆汁酸代谢异常显著,包括甘氨牛磺胆酸及其硫酸化衍生物的升高(P<0.001);脂滴稳态调节相关基因(FABP4、FABP5)和炎症相关基因(CXCL9、SPP1)显著上调。这些基因表达的变化反映了脂肪堆积和肝炎症的增加。PNPLA3 rs738409突变在该亚型中的携带率高达85%(P<0.001),显著高于其他亚型。这一变异与肝内脂质积累和炎症高度相关。
心脏代谢型(Cluster 2)
与胰岛素抵抗相关的代谢物显著增加,如4-羟基苯乙酰谷氨酰胺(P<0.001);与心血管毒性相关的代谢物(如p-甲酚葡萄糖苷)显著升高;胆固醇代谢相关基因(HMGCS1、CYP51A1)显著上调;糖酵解相关基因(ALDOC)的表达也显著增强。
临床结局的差异化表现
研究通过对UK Biobank的13.4年中位随访数据进行分析,进一步验证了两种主要MASLD亚型在临床结局上的显著差异。
慢性肝病:肝特异型的累计发病率为4.4%(HR=4.52, 95% CI: 3.88-5.26, P<0.001),心脏代谢型的累计发病率为4.0%(HR=4.04, 95% CI: 3.50-4.66, P<0.001)。
心血管疾病:心脏代谢型的累计发病率为21.9%(HR=1.80, P<0.001),肝特异型的心血管疾病发病率为9.5%(HR=1.18, P=0.054)。
2型糖尿病:心脏代谢型的累计发病率为27.3%(HR=6.82, P<0.001),肝特异型的发病率为9.3%(HR=2.91, P<0.001)。
聚类分析的临床价值与诊断优势
该研究证明,基于六个变量的聚类模型不仅能够识别MASLD的主要亚型,还在预测相关多系统结局(如肝病、心血管疾病和糖尿病)方面优于单一变量。这种方法为临床风险评估和个性化干预提供了重要工具。
针对MASLD亚型的个性化治疗策略
肝特异型MASLD:推荐使用靶向肝脂肪减少和炎症缓解的药物,如Resmetirom。这些药物能够特异性降低肝内脂质含量,显著改善肝脏功能。
心脏代谢型MASLD:需要更广泛的代谢紊乱管理策略,例如调节胆固醇和葡萄糖代谢的药物(如Lanifibranor)。GLP-1受体激动剂(如Semaglutide)能够有效降低心血管风险并促进体重管理。
这一简单而有效的工具能够辅助临床医生识别高风险患者,优化筛查和干预方案,尤其在复杂病例中表现出优越性。未来研究可进一步探索如何在其他种族和多样化人群中扩展这一模型的适用性。
综上,该研究通过聚类分析首次揭示了MASLD的两种主要亚型,并系统性地阐明了它们在分子机制、代谢特征和临床结局上的差异。这一发现为MASLD的个体化管理提供了理论基础,并为精准医疗的发展开辟了新路径。
参考文献
Raverdy, V., Tavaglione, F., Chatelain, E. et al. Data-driven cluster analysis identifies distinct types of metabolic dysfunction-associated steatotic liver disease. Nat Med (2024). https://doi.org/10.1038/s41591-024-03283-1


