Adv Sci:四环类抗抑郁药物马普替林靶向E3泛素连接酶SPOP发挥抗肿瘤作用
时间:2024-12-05 13:21:46 热度:37.1℃ 作者:网络
近年来,肿瘤免疫治疗成为癌症治疗的热点,并取得了一系列突破。[1]与放疗、化疗等传统癌症治疗方法不同,免疫治疗旨在刺激或增强免疫系统识别和摧毁癌细胞的能力。免疫治疗包括各种癌症疗法,包括基于细胞的疗法、免疫检查点抑制剂(ICI)、癌症疫苗和溶瘤病毒。ICI 是有效的免疫疗法,可以激活免疫检查点(ICP)分子,包括程序性死亡蛋白 1(PD-1)和细胞毒性 T 淋巴细胞相关抗原 4(CTLA4)相关信号通路,从而阻断炎症反应。简而言之,肿瘤细胞通过激活与 ICP 分子相关的信号通路实现免疫逃逸。ICI 可以激活 T 淋巴细胞并增强肿瘤细胞清除。
目前,主要的ICP分子包括PD-1、程序性细胞死亡配体1(PD-L1)、CTLA4、Siglec-10和分化簇24(CD24)。毫无疑问,基于人工的筛选不适合用于识别专门针对ICP相关分子的候选药物,因为这是一个耗时、昂贵且疗效有限的过程。[2, 3]已经提出了几种用于筛选免疫治疗候选化合物的计算方法。例如,吴等人通过全局基因网络关联鉴定了用于抗PD-1免疫治疗的小分子化合物。[4]王等人使用基于肿瘤免疫学特征的计算方法来识别新型免疫治疗化合物。然而,由于缺乏对ICP分子相关生物网络背后的病理过程的深入理解,这些方法的准确性较差。
基于网络的药物再利用是识别已获批准药物的新治疗应用的有效策略,可以减少药物开发的时间和成本。具有相似表型功能的基因通常在蛋白质-蛋白质相互作用 (PPI) 网络的特定区域内表现出共定位,并可形成疾病模块。基于药物靶点和疾病模块,基于网络的药物再利用可以有效筛选针对多种复杂疾病的潜在已获批准药物。例如,Misselbeck 等人将布鲁顿酪氨酸激酶 (BTK) 抑制剂依鲁替尼确定为减少与肥胖相关的慢性炎症的潜在候选药物。[11] Jessica C 等人将二甲双胍确定为治疗心房颤动的可再利用药物。 Fang 等人将西地那非确定为治疗阿尔茨海默病的候选药物。然而,基于网络的方法在针对人类癌症中 ICP 分子的药物重新定位方面尚未得到充分利用。
在这项研究中,我们开发了一个基于网络的计算框架,称为 Mnet-DRI,通过整合 PageRank、网络接近度、功能相似性和基于 RWR 的网络扩散算法,准确地重新利用已获批准药物中的 ICI。我们将 Mnet-DRI 框架应用于 PD-L1,并确定了马普替林 (MAP),这是一种四环抗抑郁药,可作为非选择性单胺再摄取抑制剂 (NSRI) 来缓解抑郁症状,作为通过靶向 SPOP 抑制 PD-L1 表达的候选药物。我们发现,结合 MAP 和抗 CTLA4 抗体可以显著增强结直肠癌和肺癌患者的抗肿瘤疗效。Mnet-DRI 框架还可以通过靶向其他免疫治疗靶点(PD-L1、CTLA4、Siglec-10 和 CD24)来重新利用计算机药物。我们相信这种方法可以最大限度地缩小基因组研究和药物开发之间的转化差距,这是精准医疗的一个重大瓶颈。
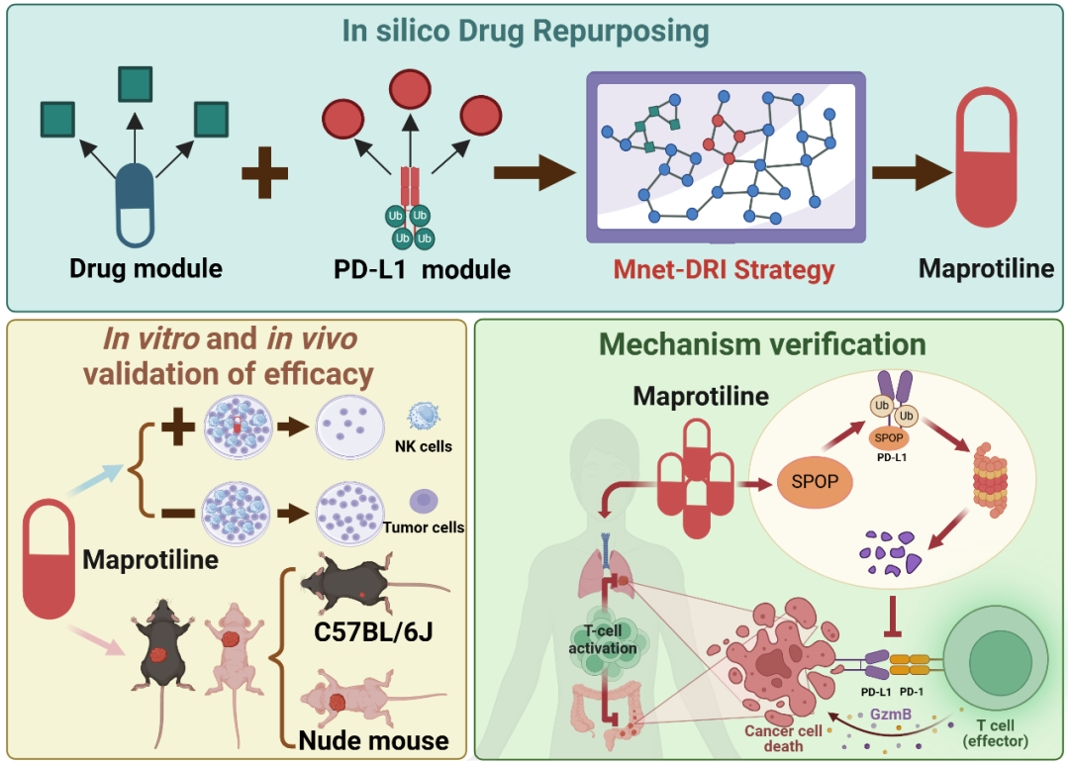
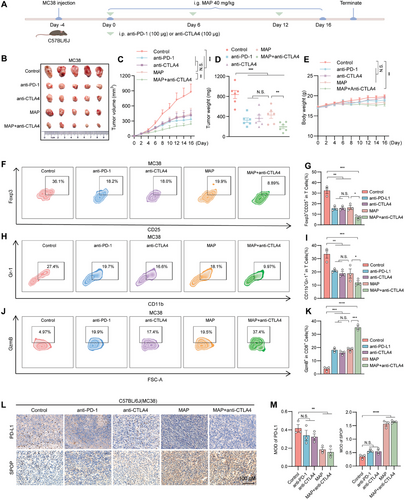
2024年11月,海军军医大学张卫东联合上海中医药大学刘三宏等团队在Advanced Science(IF=14.3)发表了题为“Network Medicine-Based Strategy Identifies Maprotiline as a Repurposable Drug by Inhibiting PD-L1 Expression via Targeting SPOP in Cancer”的文章。研究者基于网络医学策略,整合多种算法,开发了一种名为Mnet-DRI的计算框架(图4A)。进一步利用该算法筛选了已上市药物中具有肿瘤免疫治疗潜力的药物,结合表型实验结果,发现四环类抗抑郁药物马普替林能够通过降低程序性死亡蛋白(PD-L1)的表达从而发挥抗肿瘤作用(图4B-C)。接下来,研究者探索了马普替林作用的分子机制,敲除及过表达、CETSA、DARTS等实验结果表明,马普替林通过靶向E3泛素连接酶(SPOP)抑制PD-L1表达,从而发挥抗肿瘤作用(图4D-F)。此外,研究者通过体内实验发现,马普替林与抗细胞毒性T淋巴细胞相关抗原4(CTLA-4)药物具有协同作用,能够发挥更好抗肿瘤效果(图4G-H)。本研究揭示了马普替林在抗肿瘤方面的潜在应用价值,为结直肠癌和肺癌的临床治疗提供了新的策略。
原始出处:
Network Medicine-Based Strategy Identifies Maprotiline as a Repurposable Drug by Inhibiting PD-L1 Expression via Targeting SPOP in Cancer,Adv Sci (Weinh) . 2024 Nov 5:e2410285. doi: 10.1002/advs.202410285


