游离DNA及其在血液肿瘤中的临床应用
时间:2024-12-03 16:00:29 热度:37.1℃ 作者:网络
血液肿瘤在侵袭性、解剖分布和对治疗的反应方面表现出显著的临床多样性,由于它们往往比实体瘤更难通过影像学评估,准确确定反应和后续监测需要开发专门的技术。高灵敏度流式细胞术和基于 PCR 的方法现在已在多发性骨髓瘤和包括慢性粒细胞白血病(CML)和慢性淋巴细胞白血病(CLL)在内的多种白血病中常规临床应用。但它们仍依赖于可检测到的循环疾病负荷或通过骨髓活检进行侵入性评估,而对外周血游离DNA(cfDNA)进行分析,为敏感性和非侵入性地检测局限于骨髓或淋巴结的血液系统疾病提供了一种有前景的方法,可进行量化和连续监测。
在正常的细胞更新过程中,游离核酸会进入循环,其中包括来自造血细胞的大量 DNA 和 RNA。在健康个体中,cfDNA 会通过内切核酸酶降解和肾排泄迅速清除,导致单个分子的半衰期较短,血浆中的稳定态浓度相对较低。与组蛋白结合的 DNA 片段相对受到保护,而与核小体相关的 DNA 会产生一个特征性的主要群体,即短(约 165 个碱基对)的双链 cfDNA 片段。
对于血液肿瘤患者,恶性细胞的加速增殖、凋亡和坏死导致总 cfDNA 浓度增加,其中以肿瘤来源的循环肿瘤 DNA(ctDNA)为主,还有来自循环细胞、骨髓以及淋巴结或髓外疾病的贡献部分。
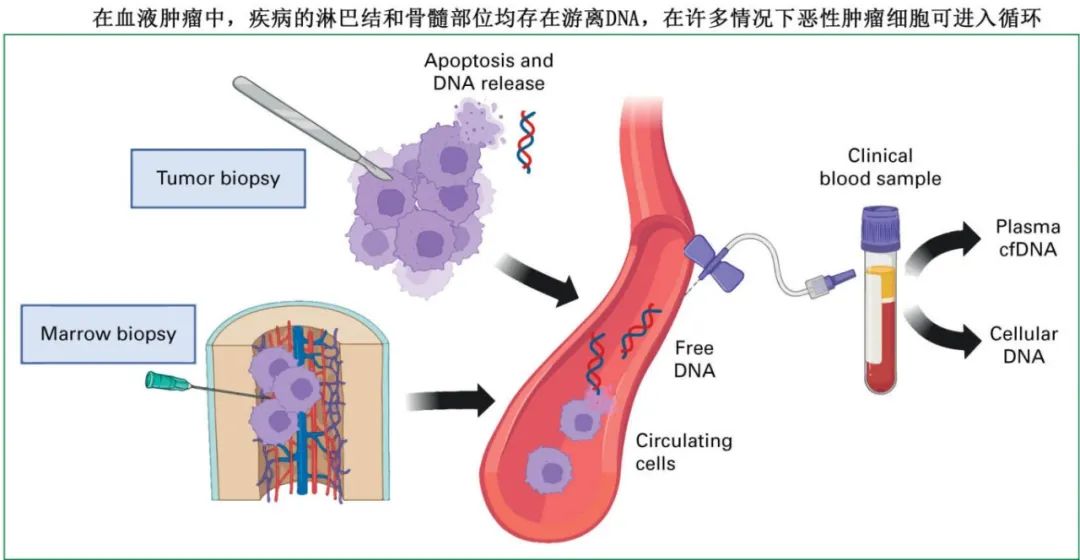
肿瘤相关 DNA 片段可通过多种非典型特征来识别,包括体细胞突变、异常甲基化和片段大小。无细胞核酸最早发现于 20 世纪 40 年代,肿瘤患者 cfDNA 的基本特征最早于 20 世纪 70 年代被描述。尽管在 20 世纪 90 年代已证明在急性髓系白血病(AML)和骨髓增生异常综合征(MDS)中检测到 cfDNA 中与肿瘤相关的点突变,但对突变分子的灵敏检测需要最近更多的技术进步,包括测序覆盖深度、保真度和纠错方面的改进。
cfDNA的临床机遇
考虑到血液肿瘤患者的疾病进程,在诊断、治疗和监测期间有多个潜在的 cfDNA 评估机会。
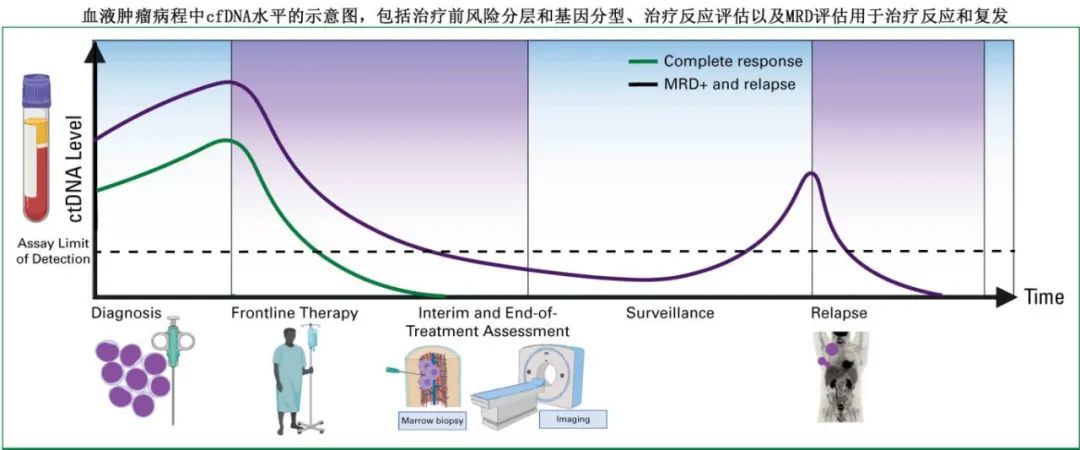
在诊断时,ctDNA 的定量分析和基因分型可能为组织学亚型和风险分层提供信息。在治疗期间,白血病中的分子反应标准已确立,而在侵袭性淋巴瘤中正在积极研究,其中已证明在两个周期化疗免疫治疗后 ctDNA 减少 2.5 个对数级可预测无事件生存期(EFS)和总生存期(OS)。除了风险分层外,中期分子反应评估可增强使用影像学反应标准开发的现有的反应适应性(response-adapted,或称根据反应调整治疗)化疗方案。在治疗后监测中,检测到 ctDNA 作为MRD对复发有很强的预测价值,并可驱动早期重新分期或额外巩固治疗。
市售的cfDNA检测法
免疫球蛋白高通量测序
淋巴恶性肿瘤的特征为 B 细胞或 T 细胞受体 V(D)J 区域的单链重排,免疫球蛋白高通量测序(IgHTS)便利用该分子特征,最初是通过对诊断性血液或肿瘤标本的测序来确定的,用于后续标本中恶性克隆型的灵敏检测。成功鉴定出优势克隆型以及充足的细胞 DNA 输入量后,IgHTS 能够实现灵敏的MRD检测,并且已获得美国FDA的临床批准,可用于B 细胞急性淋巴细胞白血病(ALL)、多发性骨髓瘤(MM)和慢性淋巴细胞白血病(CLL)患者的骨髓标本,以及 CLL 患者的外周血检测。
对于没有明显的循环疾病或骨髓受累的恶性肿瘤,也可以使用血浆 ctDNA 来评估 IgHTS。在一项开创性研究中,对 108 例弥漫性大 B 细胞淋巴瘤(DLBCL)初治患者进行了跟踪研究,经过两个周期的化疗免疫治疗后仍能检测到恶性克隆型的患者,其 5 年无进展生存率(PFS)低于 IgHTS 阴性的患者(5 年 PFS 分别为 41.7%和 80.2%)。虽然检测到的MRD对复发的阳性预测值很高,但IgHTS的分析灵敏度受到相对较低的游离DNA和白细胞来源DNA输入质量的限制。事实上,在一项针对DLBCL初始治疗后基于IgHTS的MRD监测的前瞻性多中心研究中,只有38%的复发患者在临床复发时或之前MRD阳性高于检测限(LOD),而在没有影像学疾病负担的情况下,这些复发患者中很少在治疗结束时可检测到MRD。尽管cfDNA比有细胞 DNA 的灵敏度更高,但大多数复发是通过影像学监测或临床症状检测到的,表明该方法对于淋巴瘤中具有临床意义的MRD评估可能不够灵敏。
靶向捕获测定法
通过与生物素化 DNA 寡核苷酸杂交捕获来富集感兴趣的基因组区域,由于在基因组广度和潜在的敏感度(取决于测序深度)之间实现了有效的平衡,已广泛采用。目前有多家商业供应商提供涵盖多种肿瘤中反复出现的数十到数百个癌基因的panel cfDNA 测序检测(Guardant 360、Tempus xF1+、Foundation One Liquid)。尽管这些检测主要面向实体瘤中可操作的突变,但许多靶基因也与血液恶性肿瘤有关。然而不同检测的比较显示其一致性和技术敏感性存在显著异质性(对于肿瘤确认的变异,38%至 89%),且在变异等位基因频率(VAF)<1%时观察到的性能最不可靠。尽管目前不太适合临床环境中用于常规 MRD 定量,但商业 cfDNA panel有可能在诊断时的基因分型或疑似复发且活检不可行的情况下发挥作用。
疾病特异性方法可能表现出更优的性能,其中B 细胞肿瘤相对较高的突变负荷使得能够开发出有效的标准化捕获panel,涵盖反复突变的癌基因和异常体细胞超突变所靶向的基因组区域。该方法已成为淋巴瘤中备受青睐的策略,并正在进行商业开发,来自若干临床试验的数据也已呈现。最近,密集聚集(densely clustered)的突变已用于一种名为 PhasED-Seq 的更灵敏的方法,该方法评估基因组邻近位置的多重变异。尽管在给定位置出现单个错误的可能性由测序平台的保真度决定,但在同一cfDNA 链上检测到两个相邻的肿瘤一致错误的联合概率要低得多,从而使得分析的检测限更低,对MRD的检测也更灵敏。
基于甲基化的检测法
除了肿瘤相关突变外,cfDNA 中异常的表观遗传改变随着多种基于甲基化的多癌种早期检测(MCED)的发展而备受关注。部分MCED 设计将血液系统恶性肿瘤与实体瘤一起纳入其中;例如一种使用差异甲基化位点靶向捕获的检测方法对淋巴系统肿瘤的临床敏感性达到了约 50% - 60%。尽管此类检测方法在肿瘤筛查方面显示出可能的潜力,但它们在血液系统恶性肿瘤诊断中的作用尚不清楚,并且它们在反应评估、亚型分类或MRD方面的前瞻性评估尚未开展。
基于PCR和扩增产物的方法
最后,基于定量 PCR 的诊断方法在实验室医学中得到了很好的建立,具有临床标准化、性能特征良好以及成本相对较低的优点。在CML中,通过实时 PCR 对外周血中的 BCR-ABL1 易位进行纵向检测已成为生物标志物驱动的精准医学的一个范例。在淋巴瘤中,基于 PCR 对 BCL2 (滤泡性淋巴瘤)和 BCL1/CCND1 (套细胞淋巴瘤)的复发断点区域进行定量,已用于MRD驱动的试验。
传统的基于扩增子的 PCR 方法通常局限于单个或少数几个感兴趣的基因组区域,限制了它们在不太典型的疾病中的应用。另外,大多数 PCR 技术在历史上都是使用来自外周血或骨髓白细胞的丰富 DNA 开发的,而低浓度的非血浆 cfDNA 。包括等位基因特异性和数字 PCR(ddPCR)在内的技术进步提高了性能,PCR 检测可能在涉及反复突变或易位的某些 cfDNA 应用中发挥作用。
在原发性中枢神经系统淋巴瘤中,超过 70%的肿瘤携带反复出现的 MYD88 L265P 突变,已使用脑脊液 cfDNA 对 MYD88 进行 ddPCR 评估,在两个队列中检测淋巴瘤的灵敏度分别为 73%和 71%。在外周血 cfDNA 中采用类似的方法,对经肿瘤确诊的患者检测后灵敏度较低,为 57%。在华氏巨球蛋白血症中(同样携带复发性 MYD88 L265P 和 CXCR4 S338X 突变),使用 cfDNA 进行的等位基因特异性 PCR 显示出的敏感性和一致性与骨髓穿刺物基因分型相似。
cfDNA在不同血液肿瘤中的应用
淋巴瘤
疾病测量与风险分层:治疗前 ctDNA 浓度的量化可能会增强传统的风险分层工具,如国际预后指数和国际预后评分。
基因分型与亚分类:对于侵袭性淋巴瘤,尽管切除肿瘤活检仍是标准治疗方法,但基于 ctDNA 的基因分型很可能像在许多实体瘤中一样,在肿瘤亚分类、风险分层以及可操作(靶向)突变的识别方面发挥越来越大的辅助作用。
反应评估与MRD:在以治愈为目的治疗的侵袭性淋巴瘤中,通过 ctDNA 进行的分子治疗反应引起高度关注。已经对多种分子方法进行反应评估,其中IgHTS 和靶向捕获方法的数据最为广泛。
疾病复发与细胞疗法:除了初治期间ctDNA很重要,其在复发性淋巴瘤中也有类似的用途描述,与生存期相关。
MRD评估的时间:治疗结束时的高灵敏度MRD为早期挽救治疗的治疗升级提供潜在的临床机会。治疗第二周期后也有报道。
多发性骨髓瘤
MRD评估已获得监管机构的认可,作为总生存期和无进展生存期的替代终点,但频繁的骨髓穿刺导致依从性差,且病灶斑片化分布影响准确性。诊断时使用血浆检测骨髓瘤ctDNA是可行的,但当使用单基因分析(如IgHTS)时,与骨髓相比的较低浓度似乎限制了其在MRD检测中的应用。由于骨髓瘤表现出显著的空间基因组异质性,ctDNA的潜在作用可能是在治疗前基因分型中,其中ctDNA评估突变和拷贝数改变与肿瘤有很强的一致性,可以提供比单区域活检更全面的评估。
淋系白血病
多个研究评估了 cfDNA 检测 MRD 的相对性能,证实与流式细胞术一致率较高。cfDNA 可提供整个基因组区域的全面基因分型,对于慢性淋巴细胞白血病,ctDNA 水平与通过影像学淋巴结反应测量的疾病总负荷相关。
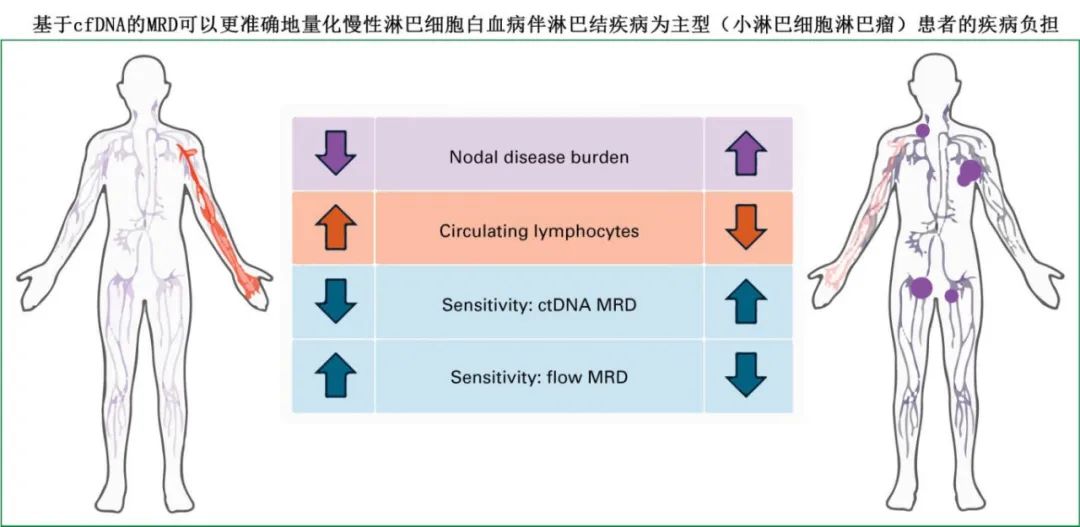
髓系白血病和MDS
对于髓系白血病,cfDNA 可用于评估髓外疾病部位、全面记录空间基因组异质性或减少连续骨髓活检操作。MDS患者通常需要连续的骨髓活检来评估治疗反应和/或进展为 AML,由于骨髓发育不全和纤维化,诊断率较低,增加了复杂性;而cfDNA 水平似乎较高,可能是由于无效造血导致细胞更新增加。尽管包括 TET2 和 DNMT3A 在内的与克隆性造血相关基因与其他血液肿瘤重叠,解读低水平变异时应保持谨慎,但与克隆性造血相关的基因的持续 ctDNA 阳性也与急性髓系白血病和AML患者治疗后复发累积发生率增加相关。
骨髓增殖性肿瘤(MPN)
一项纳入107 例 MPN患者的研究评估了 cfDNA 基因分型的效用,该研究使用配对的游离DNA和有细胞 DNA。原发性骨髓纤维化和 MPL 突变患者的 cfDNA 浓度最高,尽管与细胞 DNA 的突变一致性很高,但 cfDNA 的中位变异等位基因频率(VAF)显著更高(29% 对 25%)。存在与 MPN 相关的特征性突变可能先于明显的临床异常。
总结
cfDNA将在血液肿瘤中发挥越来越大的作用,以克服空间和解剖异质性,并减少侵入性活检。尽管基于骨髓的反应评估仍是大多数血液肿瘤的金标准,并且使用现有工具在骨髓瘤中显得更加敏感,但ctDNA也可能在某些情况下更可取,包括髓外AML和具有淋巴结为主成分的CLL。在淋巴瘤中,ctDNA被很好地表征,越来越多地纳入临床试验设计,并可能为未来的反应适应性治疗策略提供信息。
参考文献
Joseph G. Schroers-Martin et al., Cell-Free DNA in Hematologic Malignancies. JCO Oncol Pract 20, 1491-1499(2024). DOI:10.1200/OP-24-00648


