Mol Cancer:中南大学陶永光等团队研究发表肿瘤进展中调节细胞死亡及其表观遗传修饰的机制和串扰的综述
时间:2024-12-03 15:02:21 热度:37.1℃ 作者:网络
细胞死亡是后生动物生命的基本组成部分。为了维持人体细胞增殖和新陈代谢之间的平衡,需要定期去除一定数量的细胞。因此,在多细胞生物的进化过程中,细胞死亡的机制得以保留。肿瘤发生与细胞死亡的异常抑制密切相关。细胞死亡相关基因的突变或缺陷会阻碍异常细胞的消除,增强恶性细胞对化疗的抵抗力。因此,对细胞死亡机制的研究能够开发直接诱导肿瘤细胞死亡的药物。
2024年11月29日,中南大学陶永光,肖德胜,刘双共同通讯在Molecular Cancer 在线发表题为“Mechanisms and cross-talk of regulated cell death and their epigenetic modifications in tumor progression”的研究论文。该综述将总结细胞死亡途径的机制和相应的表观遗传调控。将探索这些途径之间的广泛相互作用,并讨论表观遗传学中为肿瘤治疗带来益处的细胞死亡机制。
在 2018 年更新的细胞死亡命名委员会 (NCCD) 指南中,细胞死亡根据形态学、生化和功能分类分为 12 种类型,包括内源性细胞凋亡、外源性细胞凋亡、MPT驱动的坏死、坏死性凋亡、铁死亡、焦亡、PARP-1 parthanatos、内膜细胞死亡、NETotic 细胞死亡、溶酶体依赖性细胞死亡、自噬依赖性细胞死亡、免疫原性细胞死亡、 细胞衰老和有丝分裂灾难。表观遗传学控制与癌症进展中细胞死亡之间的机制关系以前尚不清楚。

调节细胞死亡 (RCD) 的过程是细胞活性的不可逆终止,是维持组织功能和形态的重要机制。RCD 疾病会导致多种疾病。清除肿瘤细胞或免疫细胞失败分别导致诱发肿瘤发生和自身免疫性疾病的严重结果。过度的神经细胞凋亡会导致神经退行性疾病。
RCD 的研究已经进行了 30 多年。各种形式的细胞死亡表现出不同的形态学特征和潜在机制。凋亡细胞收缩导致细胞质浓缩,它们被巨噬细胞吞噬而不会引起炎症反应。然而,焦亡细胞和坏死性凋亡细胞都会经历细胞肿胀,导致细胞膜上形成孔隙,随后细胞内容物释放,并伴有严重的炎症反应。更重要的是,自噬体在经历自噬的细胞的细胞质内形成双膜结构,在那里它们与溶酶体融合产生自噬溶酶体,促进细胞器和蛋白质的降解。铁死亡已成为一个重要的研究领域,其特征是 RCD 期间其独特的形态。细胞内的铁离子和脂质过氧化物增加。铜矿病是一种尚不清楚的死亡形式,通常是由蛋白质聚集和依赖铜离子的代谢紊乱引起的。随着越来越多的细胞死亡途径的发现,迫切需要深入研究细胞死亡的分子机制,因为它对研究各种疾病的治疗方法具有深远的影响。因此,在探索细胞死亡的分子机制的同时,讨论了各种细胞死亡的相互作用和各种分子途径中分叉处细胞命运的决定,以进一步了解细胞死亡在肿瘤进展中的作用。
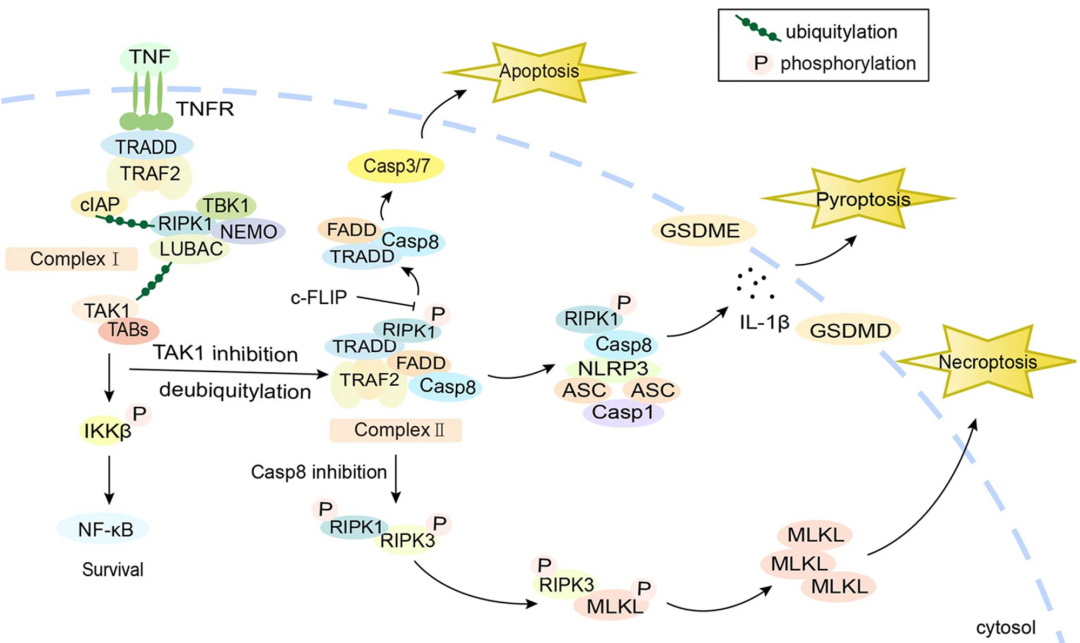
PANoptisis 之间的相互作用(图源自Molecular Cancer)
在肿瘤细胞中诱导 RCD 已成为癌症治疗的重要治疗方法。如使用细胞凋亡诱导剂(如 TRAIL、Bcl-2 抑制剂)抑制肿瘤进展,激活 Caspase-1 或 Gasdermin E 诱导肿瘤焦亡,利用 mTOR 抑制剂或自噬增强剂促进肿瘤自噬,使用铁死亡诱导剂增强肿瘤细胞中的细胞内铁离子和脂质过氧化物。然而,针对细胞死亡机制的治疗剂存在一定的局限性。例如,由于 p53 突变,一些肿瘤细胞对细胞凋亡诱导剂具有耐药性,肿瘤微环境可能会抑制细胞凋亡信号转导。此外,自噬在不同的肿瘤类型中起着复杂的作用,这可能促进生存和死亡。然而,表观遗传调控能够精确靶向特定基因表达并增强治疗效果。因此,除了常规诱导肿瘤细胞死亡外,还提供了表观遗传学在癌细胞中的关键作用,并探索了药物开发的最新进展。
主要的表观遗传调控包括 DNA 修饰、组蛋白修饰和染色质重塑。用药物对细胞死亡相关蛋白进行表观遗传调控可以更有效、更准确地达到诱导肿瘤细胞死亡的目的。
参考消息:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02172-y


