施雷雷/刘斌/马婧《AFM》:分子靶向光敏剂抑制DNA损伤修复并诱导cGAS-STING通路激活,用于卵巢癌光免疫治疗
时间:2024-11-29 11:00:24 热度:37.1℃ 作者:网络
卵巢癌是全球女性致命癌症之一,死亡率高,确诊时多为晚期且缺乏有效疗法。现有治疗手段主要是手术联合化疗,但对晚期癌症疗效仍十分有限。近年来,多腺苷二磷酸核糖聚合酶(poly ADP ribose polymerase,PARP)抑制剂的问世为卵巢癌的治疗带来了重大变革,PARP抑制剂维持治疗改变了卵巢癌的治疗模式。然而,对于携带BRCA1/2突变的患者,长期使用PARP抑制剂也可能导致耐药性的发展;对于既往使用过PARP抑制剂的患者在疾病进展后,再次使用的效果可能减弱,且可能出现严重的药物不良反应。因此发展PARP抑制剂和其他疗法的联用策略,可能为卵巢癌的治疗提供的新的方法。光动力疗法(PDT)因全身毒性低、无耐药性、微创等优点近些年在癌症治疗领域受到广泛研究。传统光敏剂通过产生 ROS 杀伤肿瘤细胞,但肿瘤细胞可通过多种机制抵抗氧化损伤,如上调PARP1修复损伤DNA等,一定程度上使得传统光敏剂疗效受限。
为解决以上难题,近期,上海交通大学医学院附属第一人民医院施雷雷研究员、新加坡国立大学刘斌院士和深圳大学马婧主任合作,发展了一种能够靶向PARP的光敏剂分子,该分子能够发挥活性氧产生、PARP活性抑制以及激活cGAS-STING通路的生物功能,为卵巢癌的光-免疫治疗提供了一种新的策略。相关研究以“A Molecular-Targeting Photosensitizer to Inhibit DNA Damage Repair System and Induce cGAS-STING Pathway Activation for Photo-Immunotherapy of Ovarian Cancer”为题,近期发表在《Advanced Functional Materials》。
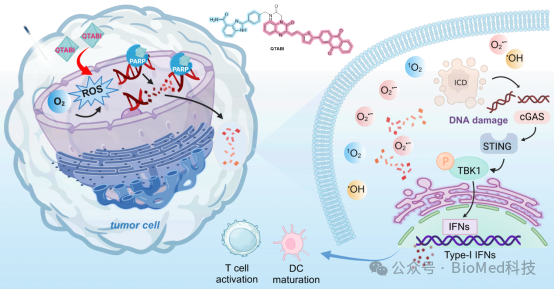
【研究内容】
作者首先基于光敏剂的结构骨架和已上市的PARP抑制剂的构效关系,设计了多种潜在的PARP靶向的活性光敏剂分子,接着利用分子对接模拟了设计分子与PARP酶的相互作用,从而设计并合成了目标分子QTABI。在光照下,该分子表现出很强的type I和II型的活性氧产生能力,对于多种卵巢癌细胞在光照和非光照下均表现出较强的细胞毒性。相较于不含PARP药效团的光敏剂分子,QTABI对于卵巢癌细胞SKOV3展现出更好的杀伤效果。紧接着,作者测试了QTABI分子和PARP酶的亲和力,并通过彗星实验、Western blotting 分析证实其能造成DNA损伤并抑制PARP活性。此外,通过与SKOV3细胞共培养的THP - 1细胞实验,WB分析、qPCR分析表明QTABI能激活cGAS-STING通路,增强卵巢肿瘤细胞免疫原性,激活先天免疫。
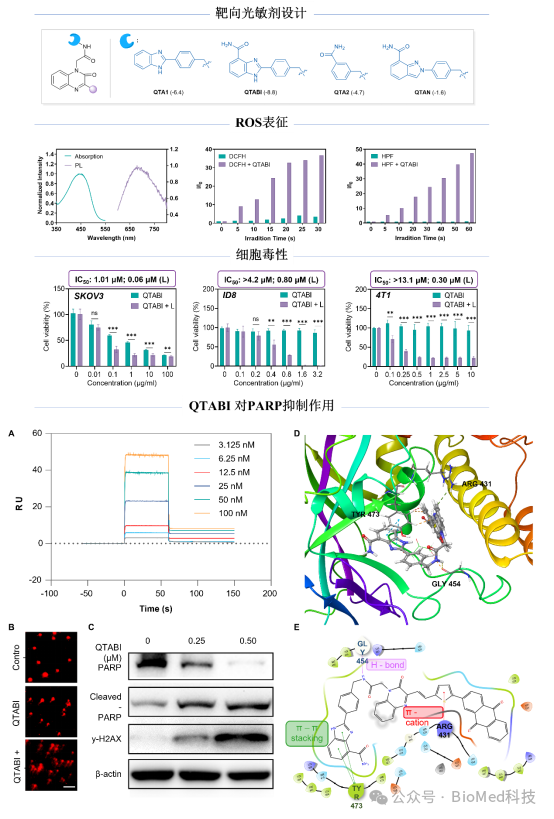
基于体外的细胞实验,作者随后评估了QTABI的抗肿瘤疗效:在卵巢癌(ID8)和乳腺癌(4T1)肿瘤模型小鼠中,QTABI NPs 光照组肿瘤生长受到显著抑制,组织学分析显示出良好的 PDT 效果,且对小鼠体重、器官组织及血液生化指标无明显影响。通过对治疗后小鼠的肿瘤组织和血清免疫分析,表明QTABI - PDT治疗能够促进DCs成熟,提高血清中细胞因子(TNF - α和 IFN - γ)的分泌,增强肿瘤组织中CD8+ T细胞的活化。以上结果表明,基于QTABI的光动力治疗能够阻碍DNA损伤修复进程,激活cGAS - STING信号通路,有力推动细胞毒性T淋巴细胞向肿瘤内部的浸润,从而显著提升光动力治疗治疗效果。
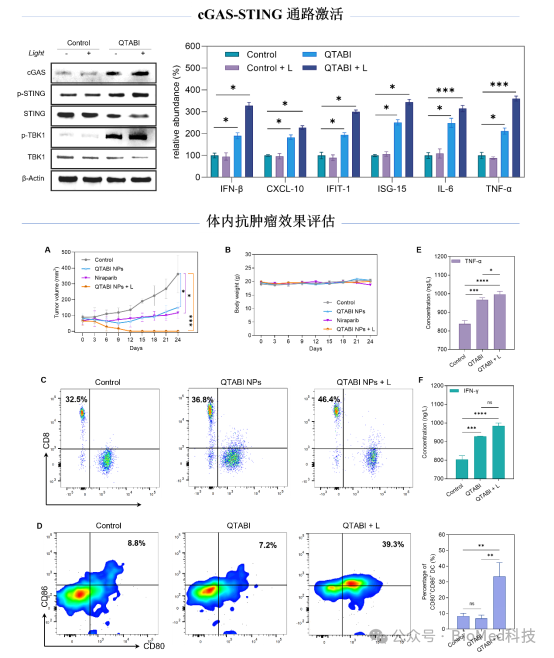
【研究结论】
作者基于PARP靶点,开发了一种活性光敏剂QTABI分子,具有良好的PARP 抑制活性和优秀的ROS产生能力,能够用于卵巢癌的光免疫治疗。在光照下,QTABI能够产生ROS诱导DNA损伤,同时抑制DNA修复过程,激活cGAS - STING通路,最终引发抗肿瘤免疫反应。该分子靶向光免疫治疗策略,克服了传统治疗和现有光敏剂的部分局限,结合了化疗与光动力治疗的优势,通过多机制协同作用提高卵巢癌治疗效果。
该研究得到了国家自然科学基金、上海浦江人才项目、新加坡总理公署(负碳合成生物学(CNSB))、深圳市科技项目、广东省自然科学基金等多个项目的资助。博士后樊连峰该论文的第一作者,施雷雷研究员、刘斌院士和马婧博士为共同通讯作者。
原文链接:


