中山大学张超/贾昭君团队《AFM》:“海洋智慧”赋能金属植入器械,自适应界面应对感染性糖尿病组织修复挑战
时间:2024-11-28 20:00:25 热度:37.1℃ 作者:网络
临床上,生物惰性金属材料(如钛及钛合金、不锈钢)广泛用于制造骨/经皮植入物及伤口闭合器械。然而,面对细菌感染、组织炎症及植入物-组织界面整合不良等挑战,特别是针对免疫受损、伤口愈合能力受损的糖尿病患者人群,这类植入物常显得力不从心。传统的涂层功能化策略虽能赋予惰性金属植入物一定生物活性,但其“一成不变”的表面设计难以兼顾糖尿病等复杂病理组织修复场景对抗感染、抗炎和促愈合功能的动态需求。
为解决这一难题,近期,中山大学张超教授和贾昭君副教授课题组,联合北京大学郑玉峰教授团队,提出了一种仿生自适应界面工程策略(MNS-TDGel),赋予惰性金属植入器械“自更新”表面特性,使其具备可按需逐步释放抗菌、抗炎及促进组织修复的生物功能。相关研究以“Bio-Inspired Self-Renewing Implant Surfaces With Sequential Biofunctional Adaptation for Infectious Diabetic Tissue Repair”为题,近期发表在《Advanced Functional Materials》。

【研究亮点】
该研究的独特之处在于其仿生设计灵感来源于海洋生物的多重智慧。研究团队借鉴了软体动物外壳的多层互锁结构、贻贝的黏附化学机制及珊瑚自更新的活性黏液层,原位构建了三明治状功能界面。这一功能界面由基体衍生的微/纳米结构底层(MNS)、仿贻贝中间粘附层(DP)以及治疗活性动态水凝胶顶层(TDGel)组成。水凝胶中的硼酸酯键、亚胺键等动态键使其能够响应酸性pH及活性氧自由基(ROS)等病理信号,局部高效释放抗菌、抗炎成分,同时适时暴露有利于细胞生长的微/纳米结构底层。
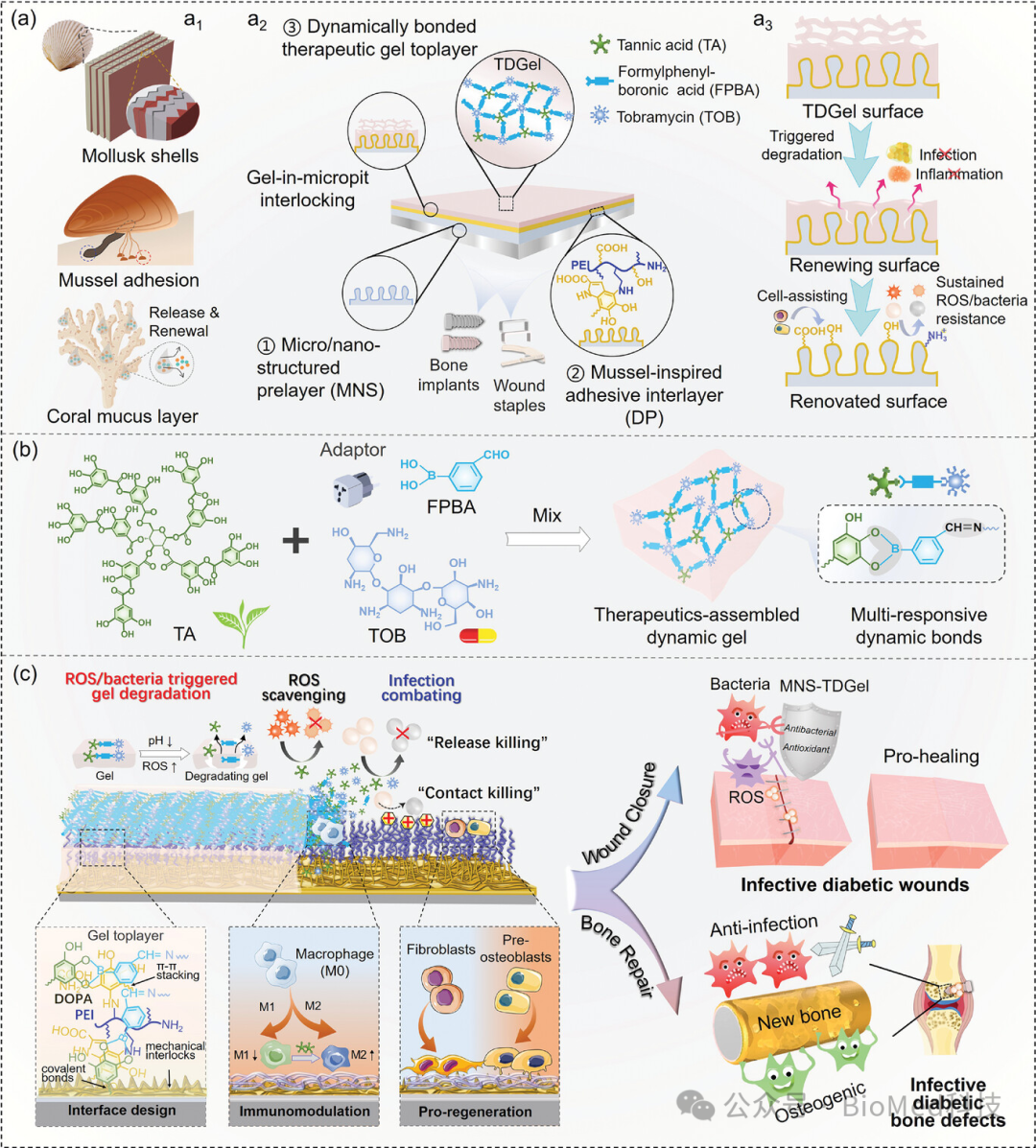
图1. 仿生自适应界面工程策略示意图:(a)海洋多重灵感启发的“自更新”植入器械表面构筑原理及作用机制;(b)TDGel自组装化学和动态响应性;(c)工程化界面基于自适应按需降解机制及适应性底层暴露发挥抗细菌感染、免疫调节抗炎和促愈合/再生功能,促进感染性糖尿病骨或皮肤组织修复。
【实验结果】
在体外、卵内及体内多种模型中,该仿生界面工程化植入器械展现出优异的性能。首先,该自更新多层界面展现出阶段性抗菌和抗氧化能力:在植入初期,TDGel顶层快速降解不仅有效清除感染还清除组织周围大量ROS;之后在长期服役过程中,所暴露出的DP中间层继续发挥长期抗菌、抗氧化/抗炎功效,为组织修复和再生营造有利条件。
在骨内、皮下和伤口闭合植入物实验中,功能化植入物表现出良好的生物相容性,具备多重抗菌/抗生物膜机制,能发挥内源/外源协同抗炎作用,并显著促进感染性糖尿病软/硬组织修复,加速植入物与组织的界面整合。尤其在糖尿病相关难治性皮肤创伤中,基于该自适应界面工程改造的金属缝合钉能够显著改善感染/炎症病理,实现糖尿病伤口无瘢痕愈合。
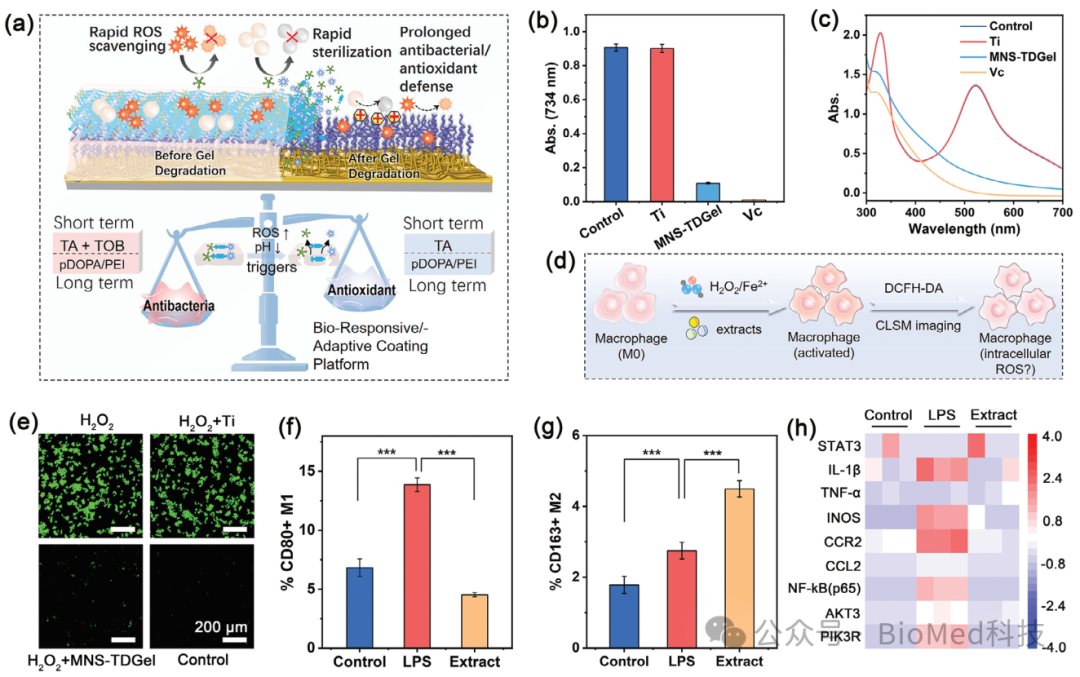
图2.(a)MNS-TDGel平衡抗菌/抗炎功能的作用机制。(b, c)ABTS•+和DPPH自由基清除试验。(d, e)胞内自由基清除性能评估。(f–h)基于巨噬细胞极化试验的抗炎免疫调节性能评估。
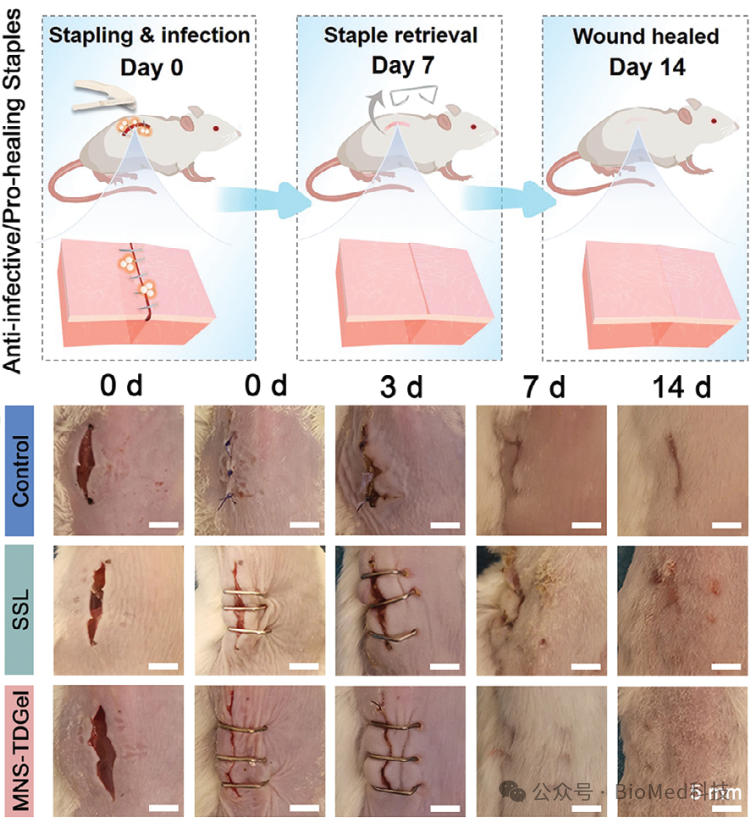
图3. MNS-TDGel界面工程化缝合钉治疗金黄色葡萄球菌感染糖尿病创伤的示意图及疗效。
【研究意义】
该项研究首次展示了具备动态生物功能转换的自更新界面如何有效应对复杂植入器械微环境、促进感染性糖尿病组织愈合,为惰性金属植入物应对复杂组织修复临床挑战的局限性提供了新的解决思路。所涉“自更新”功能界面设计理念有望拓展至其他生物医学领域,并进一步推动了海洋仿生生物材料的研发与应用。
该研究得到了国家自然科学基金、深圳市基础研究计划、广东省自然科学基金等多个项目的资助。中山大学硕士研究生崔彬为该论文的第一作者,贾昭君副教授、张超教授及北京大学郑玉峰教授为共同通讯作者。
原文链接:
https://doi.org/10.1002/adfm.202418092


