【BJH】CAR-T治疗多发性骨髓瘤的靶点及研究结果
时间:2024-11-28 14:01:17 热度:37.1℃ 作者:网络
BCMA CAR-T细胞疗法改善了多发性骨髓瘤(MM)的治疗,目前最重要的是BCMA靶点,但GPRC5D也有良好数据。现整理多发性骨髓瘤中主要CAR-T靶点及其部分研究数据。
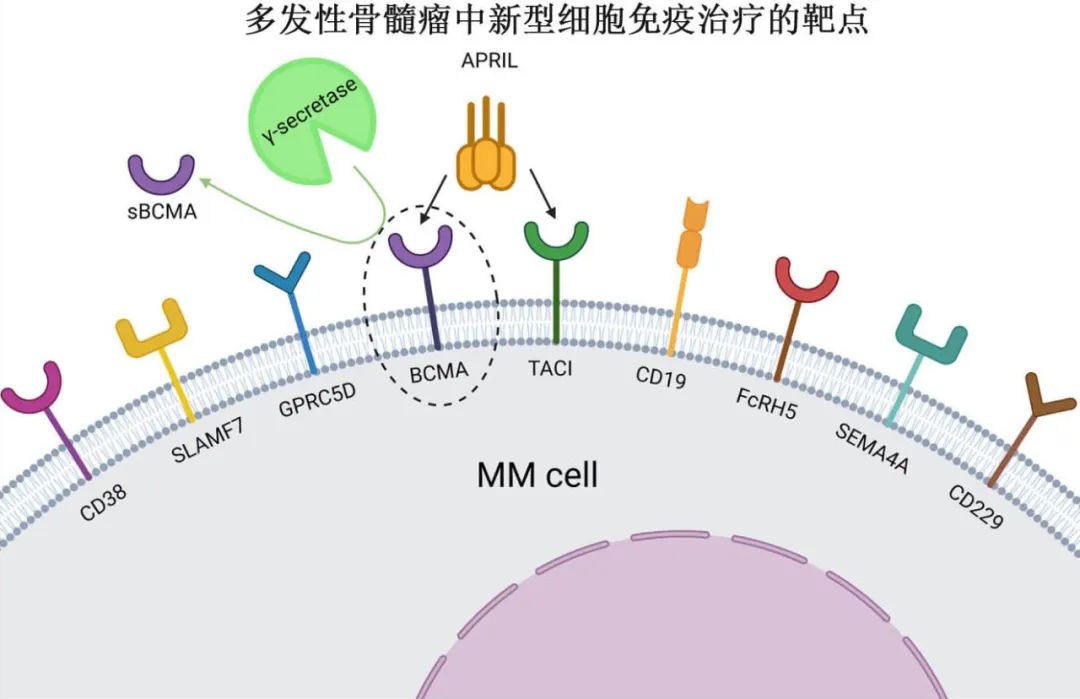
BCMA
BCMA (CD269)是一种促生存的非酪氨酸激酶受体表面糖蛋白,是肿瘤坏死因子受体(TNFR)超家族的成员,其表达仅限于晚期记忆B细胞和浆细胞,且在MM细胞中表达最高。BCMA传输下游信号,对浆细胞存活很重要。
BCMA CAR-T在重度经治MM中显示出令人印象深刻的结果。一项包含761例RRMM患者的21项研究的meta分析显示,总缓解率(ORR)为87%,完全缓解率(CRR)为44%,中位无进展生存期(PFS)为8.77个月,中位OS为18.87个月。在Idecabtagene vicleucel (Ide-cel)的KarMMa II期研究中,既往中位6线治疗的128例患者的ORR为73%,中位PFS为8.8个月;缓解深度和缓解持续时间之间存在相关性,获得部分缓解(PR)、非常好缓解(VGPR)和CR/严格意义的完全缓解(sCR)患者的缓解持续时间分别为4.5、10.4和19个月。在III期KarMMa-3研究中,Ide-cel的ORR为71%,而标准化疗组为42%,中位PFS分别为13.3个月和4.4个月;3-4级CRS发生率为5%,3-4级ICANS为3%。一项真实世界回顾性研究纳入196例患者,其中75%的患者由于合并症而不符合入组KarMMa的条件,结果ORR为84%,中位PFS为8.5个月,中位OS为12.5个月。Ide-cel的最大真实世界研究纳入603例患者,既往中位治疗7线,ORR为71%,再次与KarMMa和KarMMa-3相当;中位随访6.6个月,6个月PFS为62%、OS为82%。多因素分析发现,既往抗BCMA治疗、高危细胞遗传学和基线铁蛋白水平升高是Ide-cel后早期进展/耐药的潜在预测因素。KarMMa-2(NCT03601078)正在研究Ide-cel在早期临床高危MM患者中的作用,中期结果显示,在初始ASCT 18个月内进展的患者,ORR为83.8%,中位PFS为11.4个月。
在Ciltacabtagene autoeucel(西达基奥仑赛,Cilta-cel)的CARTITUDE-1研究纳入既往中位6线治疗的患者,ORR为97%,67%达到sCR;缓解持久,中位PFS高达34.9个月,中位OS未达到。虽然无法直接对比,但该缓解率明显优于Ide-cel和其他产品。III期CARTITUDE-4研究既往1-3线治疗的患者,来那度胺难治患者中73.1%在Cilta-cel治疗后达到CR/sCR,而仅接受化疗的标准治疗组为21.8%。在正在进行的CARTITUDE-2(NCT04133636)的B队列中,患者在早期临床复发后接受Cilta-cel二线治疗,ORR为88.9%,至首次缓解的中位时间仅为0.9个月。一项关于Cilta-cel的真实世界研究纳入236例RRMM患者,既往中位治疗6线,髓外病变和高危细胞遗传学的比例高于CARTITUDE-1,56%的患者不符合CARTITUDE-1入组标准,结果ORR为89%,≥CRR为70%,中位随访13个月后未达到中位PFS。
FHVH-T是一种具有全人源BCMA重链可变结构域的CAR,旨在降低免疫原性。在25例RRMM患者中ORR为92%,中位PFS为65周。令人惊讶的是,在4/12的评估患者中检测到体液抗CAR反应。
驯鹿的伊基奥仑赛(Equecabtagene autoleuel,CT103A)是另一种全人BCMA CAR,于2023年在中国获得有条件批准,作为四线治疗药物。在Ib/II期FUMANBA-1研究中,11.4%的患者曾接受过BCMA CAR-T治疗;ORR高达96%,CR/sCR为74.3%,12个月PFS为78.8%,12个月OS为92.2%。
科济的泽沃基奥仑赛(Zevorcabtagene Autoleucel,zevor-cel)的I/II期研究纳入14例患者,ORR为100%,≥CR为78.6%,中位PFS为25.0个月,sCR/CR 患者为26.9个月;所有患者的中位缓解持续时间为 24.1 个月,sCR/CR患者为 26.0 个月;中位OS未达到。
在正在进行的针对RRMM的CARTBCMA-HCB01研究中,患者接受人源化BCMA CAR-T ARI0002h,分三个部分,然后在≥100天后进行一次加强剂量。中期分析显示ORR为100%。
Frigault等设计的CART-ddBCMA具有独特的合成小稳定蛋白(D-Domain)作为其结合域,可降低免疫原性,提高细胞表面稳定性。在一项I期研究中,RRMM患者接受CART-ddBCMA治疗,ORR达到100%,CR/sCR为71%,在中位随访12.1个月时,86%的可评估患者为MRD阴性。该CAR (anitocabtagene autoeucel)的关键II期iMMagine-1研究(NCT05396885)正在进行中。
GPRC5D
GPRC5D是一种孤儿G蛋白偶联受体,在MM细胞中高度表达,其信号机制和功能尚未明确。表达仅限于浆细胞、皮肤(毛囊和汗腺)、舌丝状乳头和睾丸曲细精管,还发现其表达在脑干的下橄榄核中特异性富集。
MCARH109是一种人源化、慢病毒转导的GPRC5D CAR-T,采用4-1BB共刺激。在一项首次非人类剂量递增研究中,ORR为12/17(71%),在不超过150×106 CAR-T细胞最大耐受剂量的患者中,ORR降至58%。重要的是,在既往BCMA治疗后复发的患者中,有7/10出现缓解。在12例缓解中,6例在3-9个月后复发。4级毒性包括CRS(1例)、ICANS(1例)和巨噬细胞激活综合征(1例);2例患者发生3级小脑障碍,病因不明。在另一项人源化GPRC5D CAR-T的II期研究中ORR为91%,既往接受过BCMA CAR-T治疗的患者中9/9达到缓解。
徐州医科大学附属医院李振宇、徐开林团队与上海雅科生物科技有限公司合作的BCMA-GPRC5D双特异性CAR-T的I期研究中,21例RRMM患者的ORR为86%,≥CRR为62%,81%为MRD阴性;无≥3级ICANS或CRS;中位PFS和OS在中位随访5.8个月后未达到。
FcRH5
FcRH5 (CD307)属于免疫球蛋白超家族的6个基因家族,功能未知。FcRH5在所有B细胞中均有表达,在成熟B细胞中表达最高。MM细胞中的表达比非恶性浆细胞高3倍以上
苏州大学第一附属医院学者制备FcRH5-BCMA双特异性CAR-T细胞,对单独或联合表达FcRH5和BCMA的MM细胞表现出细胞毒性。最重要的是,在皮下NCI-H929异种移植模型中,FcRH5-BCMA CAR-T细胞比FcRH5或BCMA单特异性CAR-T细胞表现出更好的肿瘤浸润和更长的生存期。
CD19
CD19是B细胞受体的一种共受体,在终末分化的浆细胞和MM细胞中通常不存在。然而在一小部分不太成熟的MM细胞中可见低水平表达,并与耐药、复发和生存率低有关,因此CD19可能是理想靶点。
苏州大学第一附属医院开展探索性研究,10例高危新诊断多发性骨髓瘤(NDMM)患者接受自体移植、序贯CD19和BCMA CAR-T细胞输注以及来那度胺维持治疗,ORR为100%,sCR为90%,CR为10%。70%的患者MRD持续阴性超过2年,中位PFS和OS均未达到。
徐州医科大学附属医院开展II期研究,给予RRMM患者CD19 CAR-T联合BCMA CAR-T治疗,62例可评估疗效,ORR高达92%,MRD阴性率为77%,中位PFS 18.3个月,≥CR患者的中位PFS未达到,中位OS未达到。
徐州医科大学附属医院后续开发BCMA和CD19双特异性CAR-T(BC19 CAR-T),I/II期研究中50例 RRMM 患者接受输注,ORR为92%,sCR为36%,中位OS和PFS分别为19.7个月和19.7个月。
海军军医大学第二附属医院(上海长征医院)杜鹃教授团队开展一项I期研究,评估了自体BCMA/CD19双靶点CAR-T细胞GC012F治疗高危NDMM,19例患者ORR为100%,所有患者均达到sCR和MRD阴性,中位缓解持续时间、无进展生存期和总生存期均未达到。
总体而言,BCMA和CD19 CAR-T联合治疗晚期复发性MM和自体移植后高危NDMM的安全性和有效性已得到证实。
GC012F是利用FastCAR-T平台开发的BCMA-CD19双特异性CAR-T。在一项I期研究中,缓解率和持久性非常出色:29例患者(既往中位5线治疗)的ORR为93.1%,sCRR为82.8%。中位PFS为38个月。Lee等人目前正在评估双重BCMA/持久性CD19 CAR策略。
Roex等通过将NK-92细胞系细胞与BCMA和CD19 CAR mRNA共电穿孔,开发了双特异性BCMA-CD19 allo-CAR NK。双CAR和单CAR NK-92细胞在体外表现出相同的细胞毒性。
SLAMF7
CS1(也称为SLAMF7)参与免疫调节,在树突状细胞、单核细胞和淋巴细胞中表达,在MM细胞中表达上调,促进细胞增殖和生长。
武汉协和医院团队构建了双特异性的CS1-BCMA CAR-T细胞,在4-1BB共刺激下,将新型小鼠抗CS1 scFv和抗BCMA scFv串联在一起。在纳入16例RRMM的I/IIa期研究中,ORR和MRD阴性率为81%,sCR为38%。
CD229
CD229是信号淋巴细胞激活分子(SLAM)家族的另一成员,仅在B细胞和T细胞中表达,在MM细胞中普遍且强烈表达。CD229沉默可导致自发性MM细胞凋亡。CD229 CAR-T的疗效已经在临床前模型中得到证实,无论是作为单靶点治疗还是与CD229-BCMA双顺反子CAR-T联合使用。
SEMA4A
SEMA4A是一种参与胚胎和病理血管生成、免疫反应微调和视网膜功能的细胞表面蛋白,在MM细胞中的表达水平高于BCMA和SLAMF7。SEMA4A的缺失可导致MM细胞凋亡。人源化SEMA4A CAR-T在体外表现出强大的特异性抗MM活性。
TACI
与 BCMA 一样,TACI也是 TNFR 超家族的成员,几乎仅由浆细胞表达,并被大多数 MM 细胞上调。BCMA 和 TACI 有两种主要的天然配体:B细胞活化因子 (BAFF) 和增殖诱导配体 (APRIL)。在 I 期 AUTO2 研究中评价了 APRIL 配体作为CAR,但疗效有限,ORR为45.5%,中位 PFS 为5个月,中位 OS 为375天。与其他 BCMA CAR 相比,APRIL CAR表现出体外功能缺陷,包括靶结合减少、IL-2分泌减少和干扰素信号转导受损。已经开发出一种基于三聚体 APRI(TRIPRIL) 的CAR,以增强与 BCMA 和 TACI 的结合,目前正在临床研究 (NCT05020444) 中进行评价。
CD38
CD38在MM细胞上有较高且均匀的表达,中国已经开展了三项涉及CD38和BCMA双靶点的研究。
在武汉协和医院一项I期研究中,23例RRMM患者接受靶向BCMA和CD38的双特异性CAR-T治疗,ORR为87%,其中sCR为52%;缓解持久,中位PFS为17.2个月。荆州市中心医院的双特异性BCMA-CD38 CAR-T显示ORR为87.5%,sCR为81%。在两项研究中,≥3级CRS较常见(分别为22%和31%,包括1例死亡)。在天津市中心医院研究中,22例RRMM患者接受人源化BCMA CAR-T细胞与小鼠CD38 CAR-T细胞联合治疗,ORR为90.9%,24个月PFS为48.7%、OS为56.6%;3级CRS发生率为27.3%。
在双分裂 CD38-CD138 CAR-T 细胞中,刺激和共刺激信号被分成两个独立的刺激和共刺激CAR(sCAR和cCAR),以增加对 MM 细胞的特异性。体外最理想的组合为低亲和力 CD138sCAR 结合高亲和力CD38cCAR,该联合治疗还证明对达雷妥尤单抗经治的 CD38 表达减少的 MM 细胞的疗效。
其他靶点
-k轻链:利用相当大比例B细胞肿瘤的k轻链限制性,已发表一项抗k轻链CAR-T细胞的I期试验,但在骨髓瘤患者中未显示应答。
-NKG2D:考虑到包括骨髓瘤细胞在内的多种肿瘤上调细胞表面的NKG2D配体,报道了一些使用抗NKG2D配体CAR-T细胞的试验,但未观察到反应。
-NY-ESO-1:已报告自体 HCT 后给予抗 NY-ESO-1 TCR 工程 T 细胞的试验,与抗 CD19 CAR T 细胞治疗试验的注意事项相似,但相关研究表明存在与反应相关的潜在生物活性。
此外,许多临床前研究确定了骨髓瘤中的其他CAR-T细胞靶点,包括整合素β7、CD44剪接异构体变体6、CD56、CD70、Lewis Y抗原和白细胞免疫球蛋白样受体亚家族B成员4。
参考文献
1.Mirvis E, Benjamin R. Are we there yet? CAR-T therapy in multiple myeloma.Br J Haematol. 2024;00:1–15. https://doi.org/10.1111/ bjh.19896
2.Miller K,et al.Beyond BCMA: the next wave of CAR T cell therapy in multiple myeloma.Front Oncol . 2024 May 10:14:1398902. doi: 10.3389/fonc.2024.1398902.


