终于知道脂肪肝是怎么“吃”出来的了!Cell Metabolism最新研究表明氨基酸竟是肝脏脂肪合成的“主谋”
时间:2024-11-26 13:22:27 热度:37.1℃ 作者:网络
在忙碌的都市生活中,脂肪肝悄然成为现代人的“隐形杀手”。它不仅潜伏在那些大腹便便的中年人身上,甚至连看似健康的瘦子也难逃其魔爪。
目前,全球范围内代谢功能障碍相关的脂肪性肝病(MASLD)的患病率已飙升至30%。大部分脂肪肝与不健康的生活习惯有关。改善饮食有助于缓解或逆转已有的脂肪肝,比如适当控制热量摄入,少吃油腻食物、少喝含糖饮料等。然而,脂肪肝并不仅仅是摄入脂肪过多造成的,单纯吃得清淡也不一定能解决脂肪肝的问题。
那导致脂肪肝的罪魁祸首究竟是谁呢?
近日,广州实验室傅肃能团队能联合中科中山药物创新研究院廖一烈团队与新加坡科技研究局韩卫平团队合作,在Cell Metabolism杂志发表了研究成果,首次揭示了蛋白质而非传统认为的碳水化合物或脂肪,是肝脏脂肪生成的主要营养风险因素。该研究通过流行病学数据分析和动物实验,表明氨基酸是肝脏新生脂肪生成的主要碳提供者,并提出蛋白质摄入量对MASLD的潜在影响,为这种全球性肝病提供了新的研究方向和营养干预策略。

研究内容与思路
一、蛋白质摄入量与MASLD/MASH的发病率呈正相关
为了研究宏量营养素在MASLD(代谢相关脂肪性肝病)和MASH(代谢相关脂肪性肝炎)中的作用,作者纳入了美国国家健康与营养调查(NHANES)数据集中4693名参与者流行病学信息,分析发现碳水化合物和总脂肪的摄入量均未显示出与MASLD发病率增加有显著关联,而碳水化合物摄入量低与MASH进展风险高出约2倍有关。相反,膳食蛋白质含量与MASLD发病风险的增加呈正相关(中/高蛋白摄入组分别增加了1.45倍)。此外,高蛋白摄入会使罹患MASH的风险增加一倍,这与中/高脂肪摄入所观察到的情况类似。这些关联仅出现在肥胖参与者中,尤其是在60岁及以上的人群中。
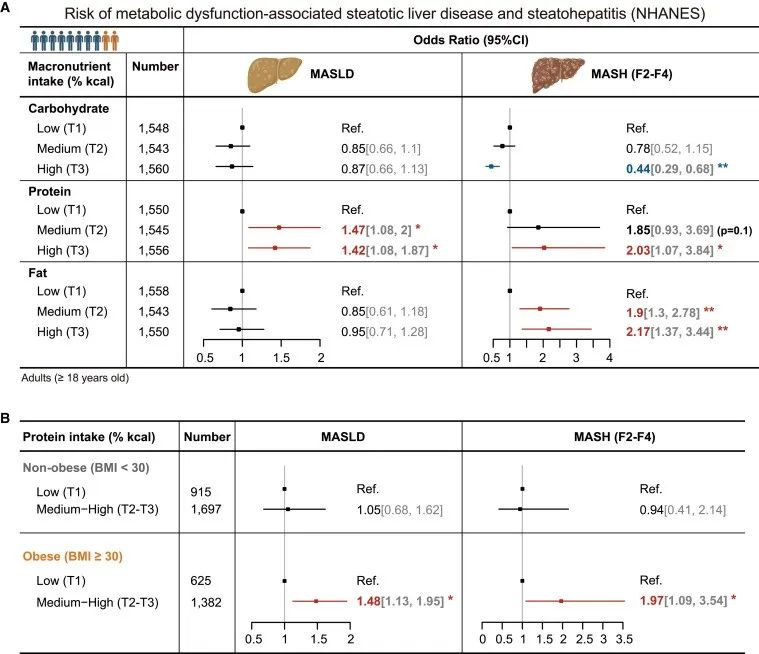
研究思路:俗话说病从口入,脂肪肝主要由“吃”引起,但是究竟是哪种营养素导致脂肪肝出现呢?一直以来并不确定。对此,作者首先利用了美国国家健康和营养检查调查(NHANES)数据库,探索了三大宏量营养素(碳水化合物、蛋白质、脂肪)与MASLD/MASH的相关性,最终发现蛋白质摄入量与其息息相关。
二、肝脏三羧酸循环的主要底物是氨基酸,而不是葡萄糖
肝脏是体内氨基酸分解代谢的主要场所。基于公共人类组学数据库的转录组分析表明,肝脏中氨基酸代谢基因的富集程度远远超过糖酵解基因。
底物偏好性测试的数据表明,氨基酸是肝细胞线粒体呼吸的主要底物。采用同位素示踪法全面评估肝脏营养代谢的转归和通量,发现13C葡萄糖主要标记了糖酵解代谢产物,而13C-谷氨酰胺主要标记了TCA中间产物,且标记量为葡萄糖的10倍。此外,原代肝细胞的葡萄糖驱动耗氧率(OCR)几乎检测不到(<5%),而作为己糖对照的果糖则诱导了30%的OCR。
这说明在肝细胞的中心碳代谢中,葡萄糖的直接贡献极低,而氨基酸是三羧酸循环的主要底物。
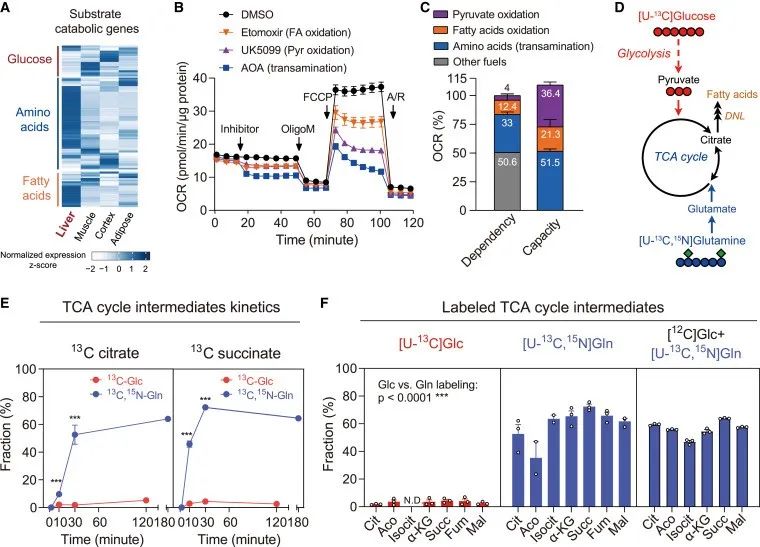
研究思路:进一步,作者从肝脏代谢角度入手,通过公共数据库分析发现氨基酸代谢基因富集程度最高,提取小鼠肝细胞原代进行底物偏好以及同位素示踪实验来观察究竟是什么物质被肝细胞大量摄取及代谢,最终发现氨基酸在肝细胞代谢中发挥主要作用,其消耗程度远高于常见能量来源葡萄糖。
PS:蛋白质是由氨基酸组成,这一发现与第一部分中蛋白质摄入量可能会导致脂肪肝结论相呼应。
三、氨基酸是肝脏新生脂肪生成的主要碳供应源
作者检测了原代干细胞中的葡萄糖和谷氨酰胺合成甘油三酯脂肪酸的通量情况,发现氨基酸(尤其是谷氨酰胺)被发现能够显著整合到细胞内的脂肪酸中,而相比之下,葡萄糖的参与度较低。实验数据显示,谷氨酰胺13C碳源的FA同位素富集度是葡萄糖的8至40倍。此外,作者还比较了氨基酸与其他公认的DNL底物(如果糖、乳酸盐和醋酸盐)对脂肪生成的影响,发现氨基酸在体外系统中对DNL的贡献最大。
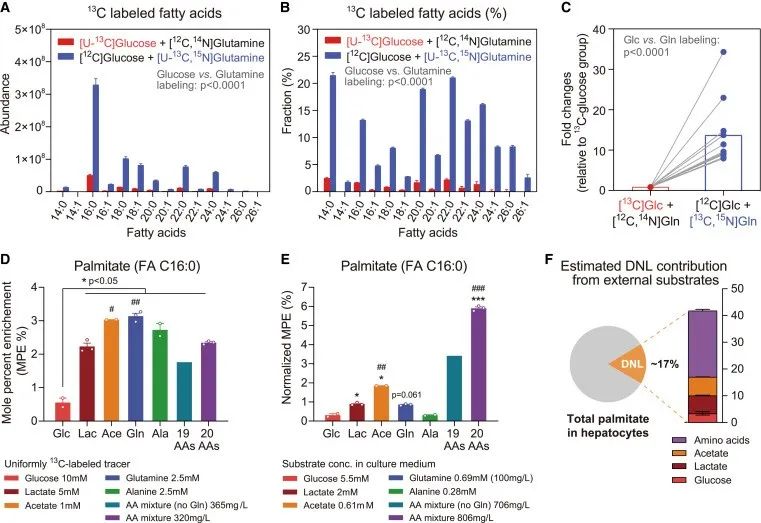
研究思路:进一步,作者量化了葡萄糖和氨基酸在肝细胞中的耗量以及生成脂肪的情况,此外,还比较了氨基酸及其他可以促进脂肪生成的底物的消耗情况,最终发现相比于任何底物,氨基酸对于肝细胞脂肪生成的贡献最大。
四、葡萄糖和氨基酸在体内代谢通量
之后,作者给予小鼠含有标记的氨基酸或葡萄糖的混合饮料来评估它们对肝脏DNL的贡献,通过24小时的饮食同位素追踪,发现在合成的新棕榈酸中,氨基酸贡献了约30%的碳,而葡萄糖贡献了约45%的碳,考虑到混合饮料中氨基酸的量是葡萄糖的1/3,则归一化后发现膳食氨基酸的脂肪生成潜力比葡萄糖大2倍或1.25倍,进一步确认了膳食氨基酸作为肝脂合成的主要碳源之一。
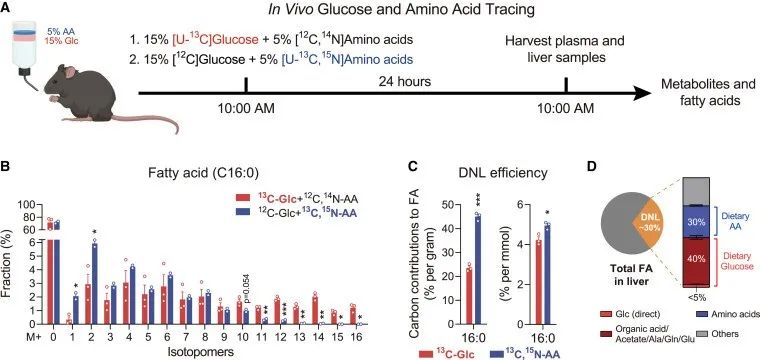
研究思路:上述都是体外实验,通过体外实验证实了氨基酸可能是脂肪肝的“罪魁祸首”。紧接着,作者开展了体内实验,进行相应的验证。给予小鼠特定饮食后,发现在小鼠体内,富含氨基酸的饮食导致的脂肪生成的确比葡萄糖饮食带来的脂肪生成更明显,与上述体外实验结论相一致。
五、肥胖小鼠肝脏的氨基酸代谢重编程
膳食营养素与MASLD/MASH风险之间的相关性在肥胖亚群中更为显著。为了检查在MASLD发育过程中氨基酸代谢通量是否改变,作者对瘦和肥胖(ob/ob)小鼠分离的原代肝细胞中进行了同位素示踪。结果发现肥胖将氨基酸代谢通量从氧化性谷氨酰胺分解转移到转氨和还原性羧化,其产物可以容易地喂养脂肪生成。此外,在肥胖状态下,肝糖酵解通量和相应的TCA回复率提高了3-5倍,13C-葡萄糖和谷氨酰胺的数量显著增加。
为了确定MASLD氨基酸代谢重编程的生理意义,作者采用化学和遗传方法评估谷氨酸和谷氨酰胺的代谢和产脂影响。发现增强谷氨酰胺氧化可以抑制脂肪酸的合成,减少肝细胞内的甘油三酯积累。
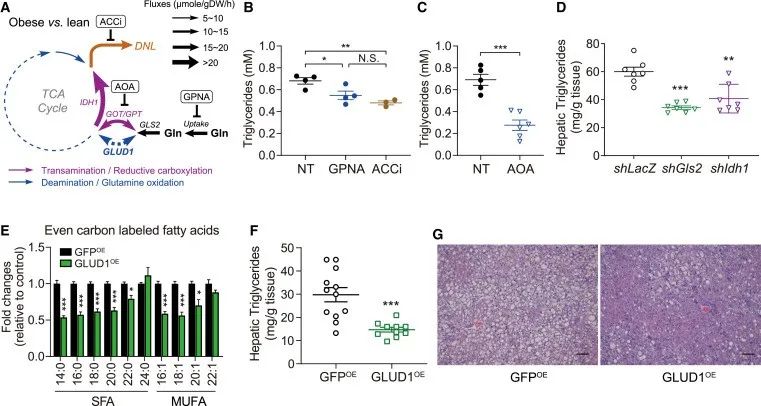
研究思路:既然氨基酸可以促进脂肪生成,那么肥胖小鼠与瘦小鼠体内的氨基酸代谢情况是否存在差异?存在什么差异?结果发现在肥胖小鼠体内,谷氨酰胺被分解,从而失去氧化性,从抑制脂肪合成变为了促进脂肪生成的底物。
六、限制饮食蛋白质可减轻肝脏脂肪变性
为了进一步研究氨基酸驱动的DNL对MASLD的影响,作者让患有肝脏脂肪变性的肥胖小鼠自由进食标准或低蛋白饮食(LPD)(25%对5%千卡蛋白质)3周。结果发现蛋白质限制减少了食物和水的消耗量,防止了体重增加。病理检测发现肝脏脂质积累减少,肝损伤减轻。从机理上讲,LPD抑制了大多数致脂基因的表达,包括Scd1/2、Acly、Acss2、Fasn和Fabp5。MASLD风险基因Pnpla3的表达也显著下调。相比之下,作为氨基酸剥夺标志的Fgf21被诱导了8倍多。基因组富集分析(GSEA)证实,脂肪酸代谢是下调最多的途径。DNA复制和细胞周期也明显减弱。相比之下,与核糖体和胆汁酸代谢相关的通路却上调了,这可能是一种补偿机制。
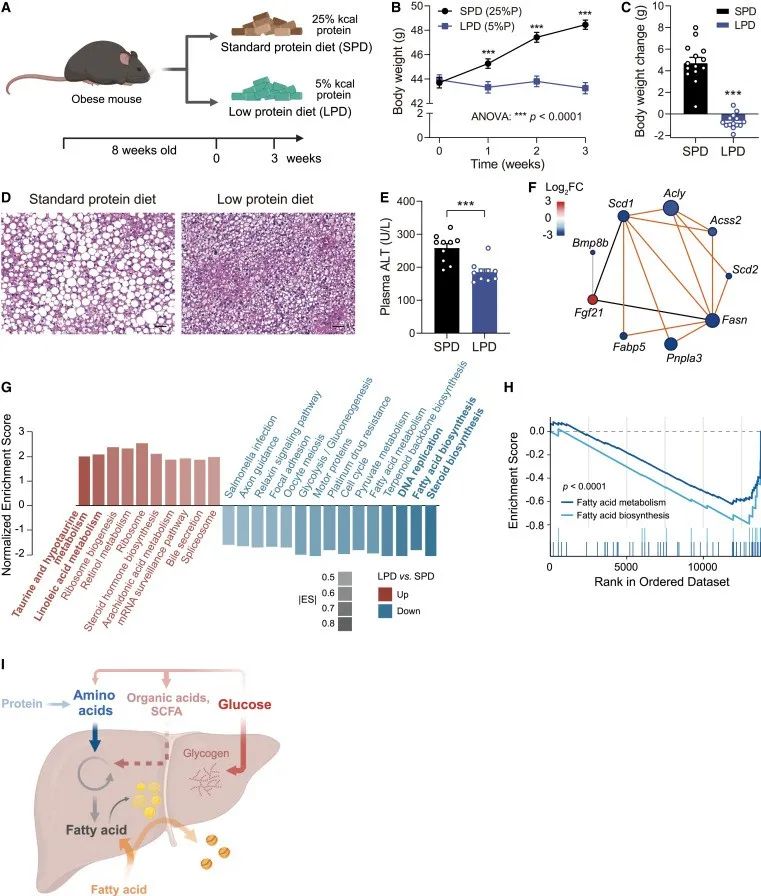
研究思路:以上都是基于体内外实验得出的结论,那么,是否具有实际意义呢?对此,作者限制了肝脏脂肪变性的肥胖小鼠的蛋白质摄入,发现蛋白质摄入被限制后的确可以显著改善肝脏脂肪积累,将其赋予了实际意义。
小结
这项研究发现氨基酸是肝脏新生脂肪生成的主要碳来源,限制膳食蛋白质可以减轻肥胖小鼠的肝脂肪积聚和肝脏损伤,提示氨基酸代谢的重新编程在MASLD发病中的关键作用,给予了我们新的研究方向,比如蛋白质饮食对于肝脏纤维化的影响?比如对于其他脏器的影响等。
可能有人会问,低蛋白饮食就一定好吗?
蛋白质饮食的代谢受多种氨基酸影响,高蛋白饮食(≥35%热量)也可能减少全身和肝脏的脂肪沉积,因此,需要进一步研究以评估特定氨基酸类别在代谢中的不同功能,目前还不能笼统地将视为作为脂肪肝的治疗方法。
参考文献:
[1] Wang Z, Yuan C, Zhang Y, et al. Food inflammation index reveals the key inflammatory components in foods and heterogeneity within food groups: How do we choose food?. J Adv Res. Published online October 12, 2024. doi:10.1016/j.jare.2024.10.010


