异基因CD34+造血干细胞boost治疗ALL CART后长期血细胞减少的11例报道
时间:2024-11-25 18:01:08 热度:37.1℃ 作者:网络
CD34+ boost
CAR-T细胞疗法是复发难治性B细胞急性淋巴细胞白血病(r/r B-ALL)的有效疗法,但其血液毒性导致外周血细胞减少是最常见和最严重的长期不良反应之一。此外,重度血细胞减少会导致危及生命的出血和感染事件,是CAR-T细胞治疗后发病率和死亡率的主要驱动因素。
CAR-T输注后长期血细胞减少的潜在病理生理机制仍然知之甚少,也缺乏指导管理的数据,存在较大的临床挑战。其治疗包括输血支持、使用粒细胞集落刺激因子、血小板生成素类似物和红细胞刺激剂。造血干细胞(HSC)boost也用于治疗CAR-T细胞治疗后移植物功能差,主要是冷冻保存自体输注,而使用异基因CD34+ HSC的经验仍极少。
西班牙学者开展了一项多中心回顾性研究,纳入11例接受二代抗CD19 CAR-T治疗的r/r B-ALL儿童和成人患者,患者在CAR-T后发生长期血细胞减少症并接受异基因未经处理的供者来源的CD34+ boost治疗。结果近日发表于《Bone Marrow Transplantation》。

研究结果
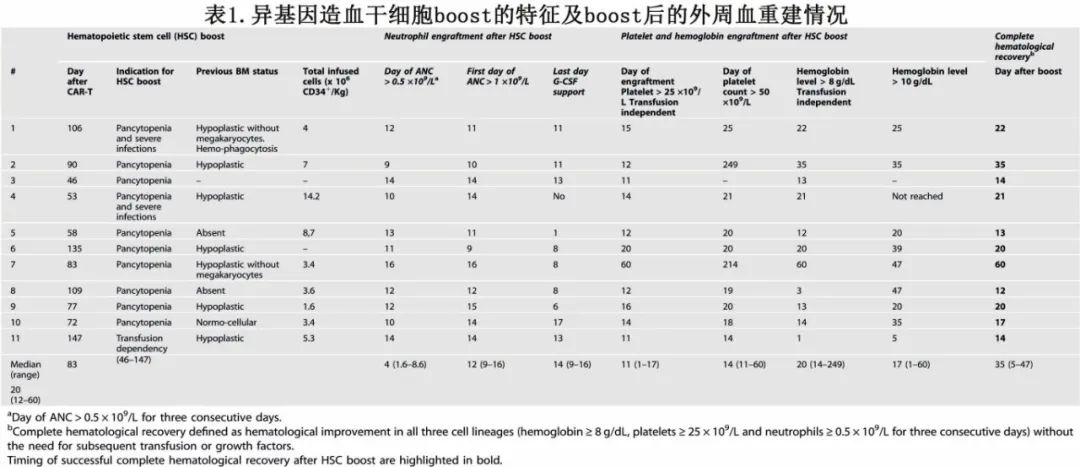
该研究纳入11例接受二代抗CD19 CAR-T治疗的r/r B-ALL儿童和成人患者,患者在CAR-T后发生长期血细胞减少症并接受异基因未经处理的供者来源的CD34+ boost治疗。中位年龄为27岁(4-86岁)。从异基因造血干细胞移植(allo-HSCT)到复发的中位时间为6个月(范围3-24.1),从allo-HSCT到CAR-T细胞输注的中位时间为8.6个月(范围5.3-20.9)。多数既往治疗≥4线。
11例患者在CAR-T输注后第28天出均现重度难治性中性粒细胞减少症和/或血小板减少症。在CD34+造血干细胞boost之前有多例危及生命的感染。
从CAR-T细胞输注到供者CD34+ HSC boost的中位时间为2.8个月(范围1.5-4.9)。CD34+的中位选择剂量为4×106/kg(范围1.6-14.2),10例>3×106/kg。在7例可获得信息的患者中,中位CD3+ T细胞剂量为8.3×103/kg受者体重(范围1.14-40)。所有患者在CD34+ boost前均获得完全供体嵌合。
总的来说,在CD34+ boost后,所有11例患者的血细胞计数都有所改善。boost后完成血液学恢复的中位时间为20天(范围12-60天)。患者资料见表1。
末次随访时无事件生存期(EFS)为27.3%(3/11),中位EFS为10个月。移植后6个月和6个月复发患者的EFS值分别为14.3%和75%(p=0.016)。CD34+ HSC boost后中位随访12个月, 12个月和24个月总生存率(OS)分别为51.9%和31.2%,中位OS为21个月。CD34+ HSC boost后的所有死亡原因均与疾病复发相关。
总结
基于该研究结果,如果在CAR-T细胞治疗后原发移植物功能不良的情况下原始供者可用,则应强烈考虑提供CD34+ HSC boost。未来的挑战包括在r/r B-ALL人群中确定boost前血液学毒性评分,以优化患者选择,并就该治疗方法制定治疗共识,包括最佳时机和CD34+造血干细胞boost剂量。
参考文献
Molinos-Quintana A,et al.Successful allogeneic CD34+ hematopoietic stem cell boost for prolonged cytopenias following CAR T-cell therapy in B-cell acute lymphoblastic leukemia. On behalf of the Spanish Group for Hematopoietic Transplantation and Cellular Therapy (GETH-TC).Bone Marrow Transplant . 2024 Nov 17. doi: 10.1038/s41409-024-02473-2.


