临床研究|ALT水平正常的慢性乙型肝炎患者的血清学特征及肝组织病理学分析
时间:2024-06-16 06:00:49 热度:37.1℃ 作者:网络
根据世界卫生组织最新全球调查研究,2020年全球5岁以下儿童HBsAg感染率为0.94%,每年新增HBV感染人口150万,每年死于乙型肝炎及其并发症约82万。2016年,世界卫生组织制定了全球性战略目标,旨在2030年之前消除病毒性肝炎这一全球性公共卫生威胁,将新发感染人数降低90%,死亡率降低65%。中国感染HBV的患者高达7 000万,这给中国完成2030年消除乙型肝炎的任务带来了严峻挑战。中国的HBV感染主要通过母婴传播途径,往往伴随着一个持续时间较长的免疫耐受期,表现以ALT水平持续正常为特征。多项回顾性研究及荟萃分析结果表明,ALT水平持续正常患者的肝组织并不总是完全“正常”的,有40.0%~70.0%的肝组织已经出现显著的炎症坏死(G≥2)或纤维化(S≥2),部分甚至隐匿发展为肝硬化、肝细胞癌。
血清HBV DNA定量是评估HBV复制强度最主要的指标,用于评估疾病病程、确定抗病毒时机、判断疗效及预后等多种用途。1996年德国科学家Köck在人体外周血清中发现HBV RNA。HBV RNA的本质是肝细胞核内闭合环状DNA(cccDNA)未经逆转录的前基因组RNA(pgRNA),未能有效地转录成松弛环状DNA(rcDNA),而是以病毒样颗粒的形式释放进入血液循环,最终形成“HBV RNA病毒样颗粒”。不同于HBsAg水平受cccDNA的转录和翻译及宿主基因的HBV DNA转录的影响,HBV RNA是cccDNA模板的直接下游产物,能更准确地反映核cccDNA库,尤其在已使用抗病毒治疗的患者中。对已使用抗病毒治疗的人群有研究显示血清HBV RNA与肝组织病变程度及疾病进展均有关,而与未经治疗患者无关。本研究旨在对不同正常水平ALT的CHB患者的肝组织病理与血清学指标相关性进行分析,为指导抗病毒药物使用的启动时机提供进一步依据。
1资料与方法
1.1 研究对象
收集2018年4月—2021年6月就诊于无锡市第五人民医院ALT水平正常的CHB患者的临床资料。所有血清学标本均收集于肝活检前。筛选标准:HBsAg阳性、HBV DNA阳性,血清AST、ALT水平持续正常(1年内持续随访3次,每次至少间隔3个月)。排除标准:既往抗HBV治疗史;合并其他病毒性肝炎、酒精性肝炎、非酒精性脂肪性肝炎、自身免疫性肝病、结缔组织病、药物性肝损伤、遗传代谢性疾病、累及全身系统性疾病等;明确肝硬化患者;妊娠患者;合并有血液系统疾病、恶性肿瘤等;合并HIV感染者。
1.2 HBV RNA的检测
由上海仁度生物科技股份有限公司提供血清HBV-pgRNA定量检测。使用HBV RNA实时荧光核酸恒温扩增法(SAT)试剂盒HBV-SAT kit(Shanghai Rendu Biotechnology Co.,Ltd,China)在AutoSAT全自动核酸检测分析系统上进行检测。具体操作按照AutoSAT仪器和试剂说明书进行。检测范围102~108拷贝/mL,检测下限为50拷贝/mL。
1.3 肝穿刺活检
所有患者进行肝穿刺活检前完善血常规、凝血功能、腹部超声等常规检查,排除穿刺禁忌证,签署肝穿刺活检知情同意书。患者去枕平卧位,手上抬平放至头部上方,B超引导下进行肝穿刺部位定位,对穿刺部位进行消毒,操作者戴无菌手套,铺巾,局部浸润麻醉,嘱患者配合呼吸,在B超引导下使用一次性全自动肝活体组织检查获得肝组织2条,置于4%甲醛溶液中进行组织固定,后续进行脱水、石蜡包埋、切片。肝组织分别予以HE染色、网状纤维染色、Masson染色、免疫组化染色(HBsAg和HBcAg)。
1.4 肝组织病理学诊断
采用我国新修订的慢性肝炎的病理学诊断标准。将肝脏炎症活动程度≥G2定义为显著性炎症,纤维化程度≥S2定义为显著性纤维化。收集肝组织内HBsAg、HBcAg的免疫组化结果、肝脏炎症活动程度、肝纤维化分期及有无合并肝脂肪变性。
1.5 统计学方法
采用SPSS 26.0软件进行统计学分析,计数资料组间比较采用χ2检验。采用Speraman秩相关进行相关性分析。采用Logistic回归进行多因素分析。P<0.05为差异有统计学意义。
2结果
2.1 一般资料
本研究共纳入137例CHB患者。其中男71例(51.8%),女66例(48.2%)。ALT≤20 U/L 47例,20~29 U/L 58例,30~40 U/L 32例。处于免疫耐受期6例(4.4%),处于免疫清除期0例,处于免疫控制期25例(18.2%),处于再活动期2例(1.5%),处于不确定期104例(75.9%)。
2.2 肝组织病理检查结果
CHB患者肝穿刺结果见表1。炎症活动程度分级以G2级(n=69,50.4%)为主,≥G2级82例(59.9%);肝纤维化分期以S0~1期(n=47,34.3%)、S2期(n=47,34.3%)为主,≥S2期90例(65.7%)。ALT≤20 U/L、20~29 U/L、30~40 U/L组分别有57.4%、53.4%、75%的患者发生显著炎症坏死(≥G2),63.8%、62.1%、75%发生显著纤维化(≥S2)。
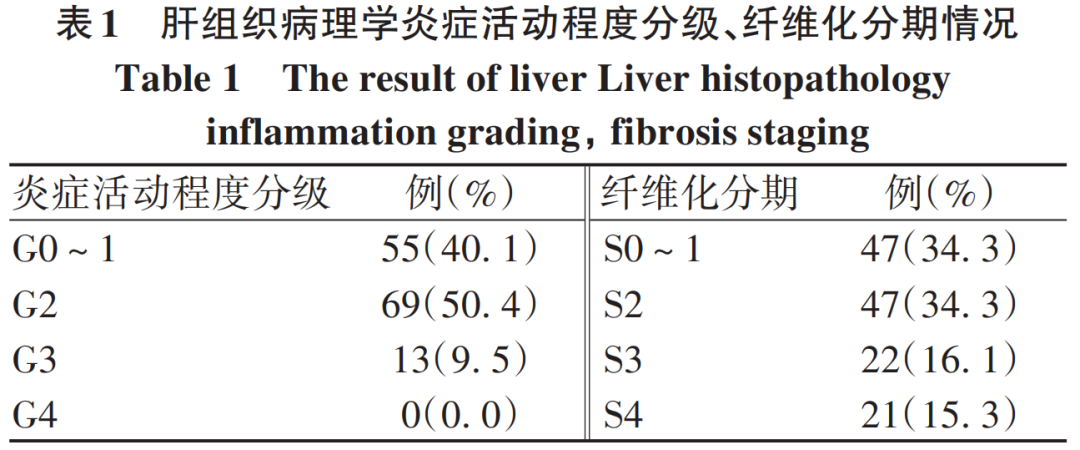
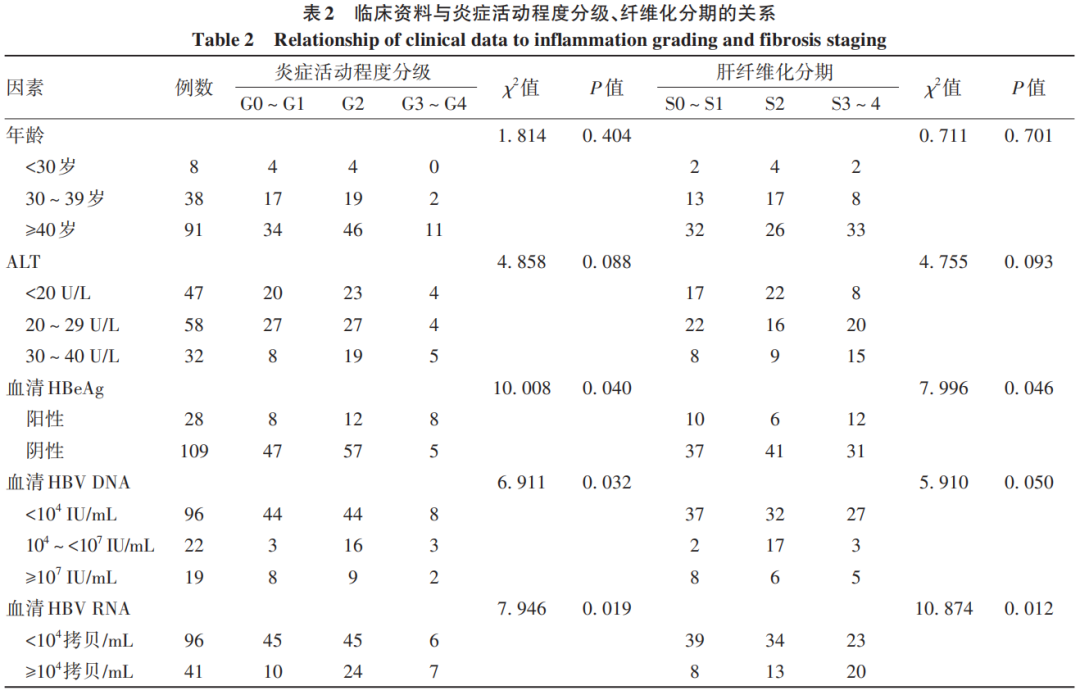
2.3 临床资料与炎症活动程度分级和纤维化分期的关系
HBeAg阳性患者的炎症活动程度分级、肝纤维化分期与HBeAg阴性患者之间差异均有统计学意义(P值均<0.05);不同水平的血清HBV DNA组间炎症活动程度分级差异有统计学意义(P<0.05),而纤维化程度差异无统计学意义(P=0.05);不同水平的血清HBV RNA组间炎症活动程度分级、纤维化分期差异均有统计学意义(P值均<0.05)。不同年龄、不同ALT水平的炎症活动程度分级及纤维化分期差异均无统计学意义(P值均>0.05)(表2)。
2.4 相关性分析结果
CHB患者的炎症分级与肝纤维化分期之间存在相关性(rs =0.732,P<0.05)。HBeAg阳性与血清HBV DNA、血清HBV RNA均呈现出正相关性(rs =0.513,P=0.006;rs =0.800,P<0.001)。血清HBV DNA水平与炎症活动程度分级、纤维化分期之间无相关性(rs =0.024,P=0.785;rs =0.039,P=0.652)。血清HBV RNA与炎症活动程度分级、纤维化分期之间存在显著相关性(rs =0.222,P=0.009;rs =0.187,P=0.029)。血清HBV DNA与血清HBV RNA间无相关性(P=0.050)。
2.5 多因素Logistic回归分析
将ALT、HBeAg、HBV DNA、HBV RNA血清学指标纳入多因素Logistic回归分析,结果提示HBeAg阳性是ALT水平正常的CHB患者肝脏发生炎症坏死(OR=-0.302,95%CI:-1.160~0.386,P=0.002)及纤维化(OR=-0.387,95%CI:-1.160~0.386,P=0.011)的独立危险因素。
3讨论
HBV感染约95%发生在婴儿期和幼儿期,相比之下仅有不到5%在成年后感染。国内外指南将CHB感染过程分为4个阶段:HBeAg阳性慢性HBV感染(又称免疫耐受期、慢性HBV携带状态)、HBeAg阳性CHB(又称免疫清除期、免疫活动期)、HBeAg阴性慢性HBV感染(又称非活动期、免疫控制期、非活动性HBsAg携带状态)和HBeAg阴性CHB(又称再活动期)。然而临床上存在ALT水平正常、HBV DNA高水平、HBeAg阳性,看似属于HBeAg阳性的慢性HBV携带状态,即免疫耐受期,但其肝组织已出现明显炎症坏死或纤维化,根据血清HBV DNA及ALT水平难以明确感染分期,2016年和2018年美国肝病学会(AASLD)CHB指南将这一情况称为不确定的“灰色地区”。2021年新加坡的一项大队列研究对处于不确定期未经治疗的非肝硬化的CHB患者进行了平均约12.5年的长期随访,结果显示约有40%患者处于不确定期,持续处于不确定期CHB患者的肝细胞癌风险比不活跃期的CHB患者高14倍,表明不确定期的患者疾病进展风险极大,需要进一步评估抗病毒治疗的时机。中国《慢性乙型肝炎防治指南(2022年版)》新增“不确定期”,这部分患者占CHB患者的28%~55%。而本研究纳入的137例ALT水平正常的CHB患者中,75%处于不确定期,65.7%已达到抗病毒指证,比既往研究结果高,因本研究纳入人群为ALT水平正常的CHB患者,其血清HBV DNA、肝脏病理并不完全一致,致使难以明确分期的患者比例较高。
ALT作为肝细胞受损时最灵敏的肝酶指标,其升高通常被作为抗病毒治疗的指征之一。本研究显示ALT水平正常的CHB患者的肝组织约59.9%显著炎症坏死,65.7%显著纤维化。进一步将ALT分为不同正常水平研究,结果显示不同正常水平ALT组间炎症活动程度和纤维化程度无明显差异。纪林秀等对ALT水平正常及轻度升高的CHB患者的肝组织活检研究显示,随着ALT水平升高,肝组织的炎症坏死及纤维化程度均加重,这与本研究结果不同,可能因为随着HBV感染的进展,ALT水平逐渐升高,病毒复制引起的免疫反应对肝细胞的损害及炎症坏死逐渐加重,而炎症坏死持续存在或反复出现是慢性HBV感染者病情进展为肝硬化甚至肝癌的重要因素。但若病毒的免疫反应仅引起炎症和纤维化,而未损伤肝细胞,此时位于肝细胞质内的酶未释放入血,血清ALT可处于正常水平。因此,血清ALT水平不能完全准确反映HBV感染者肝脏的病理改变,且其水平受到多种因素的影响。
本研究显示ALT水平正常的CHB患者的肝脏炎症活动程度分级与纤维化分期之间存在正相关性,随着炎症程度的升高,纤维化程度越严重。ALT水平完全正常时,HBV长期感染使得肝脏反复出现炎症活动,持续不断的炎症活动持续刺激肝星状细胞活化、增殖,使得细胞外基质增生、沉积,导致肝组织内纤维化的程度逐渐升高。
HBV复制周期中,闭合环状DNA(cccDNA)作为乙型肝炎周期的中心,血清HBV DNA定量直接反映cccDNA的水平,即HBV的复制水平。本研究显示不同血清HBV DNA定量与炎症分级、纤维化分期之间均无相关性,这与周旋等的研究结果一致。周保仓等研究显示血清HBV DNA与肝脏炎症等级呈正相关,与纤维化分期无相关性。上述结果存在一定差异的原因可能是慢性HBV感染是动态活动过程,是病毒和宿主免疫系统相互作用的结果,随着感染时间的增加,病毒在体内的拷贝数呈现指数级增长,且HBV cccDNA在肝细胞核中复制转录后,病毒基因组包裹在细胞质的衣壳中,逃避宿主的免疫监视,机体的免疫应答未能应对或出现免疫耐受,致血清HBV DNA与肝组织改变间无相关性。
血清HBV RNA作为慢性HBV感染的新型标志物,目前研究主要集中于抗病毒治疗后的变化。本研究对未经治疗且ALT水平正常的CHB患者研究显示,血清HBV RNA与肝脏炎症程度及纤维化分期之间存在正相关性(P值均<0.05),这与Liu等的研究一致。Bai等研究显示pgRNA病毒粒子的包膜蛋白结构与HBV DNA病毒粒子相似,且细胞外HBV RNA具有作为合成病毒DNA模板的能力,细胞外HBV pgRNA病毒粒子可能具有感染性,使得肝组织内持续的病毒感染、复制,持续的炎症反应导致肝组织发生病变,炎症坏死及纤维化程度逐渐升高。
本研究还发现血清HBV RNA与血清HBV DNA无相关性。这可能与HBV在肝细胞内的复制过程有关。cccDNA下游的pgRNA有两种去路,其一是被衣壳内的聚合酶通过逆转录将pgRNA转化为rcDNA,再被病毒蛋白(HBsAg脂蛋白外膜)包裹成一个新的完整的HBV释放到细胞外或进入细胞核内补充cccDNA池;其二是由HBcAg组成的核衣壳包裹,形成HBV RNA病毒颗粒并通过多种途径出胞,最终进入外周血中。同时,病毒粒子出胞途径有多种,血清HBV DNA病毒粒子是通过天然内体分选复合体(ESCRT)依赖性多泡体途径输出,研究报道裸衣壳的输出是由ESCRT-0成分(肝细胞生长因子调节的酪氨酸激酶底物)和ESCRT-Ⅲ结合蛋白Alix辅助的,是完整的独立于ESCRT通路。肝细胞中是否存在裸衣壳分泌途径仍有待确定。另一方面,CHB患者血液中的一些裸衣壳可能直接来源于肝脏炎症过程中凋亡的HBV阳性细胞,而不依赖于上述途径。也有可能一些循环衣壳直接从受损的(破碎的)病毒粒子中释放。这些不同的释放路径都会影响血清HBV RNA在外周血中的定量。
本研究多因素Logistic回归分析显示,HBeAg阳性是CHB患者肝组织发生炎症坏死及纤维化的独立危险因素,与Bai等研究结果一致,且随着HBeAg的升高,血清HBV DNA、HBV RNA逐渐升高。HBeAg阳性提示HBV复制活跃,传染性强,复制过程产物均升高,肝组织出现炎症及纤维化。
总之,ALT水平正常的HBV感染者存在不同程度的显著炎症坏死及纤维化,且不同正常水平ALT的CHB患者间无明显差异,HBeAg阳性是这类患者肝组织出现显著炎症坏死及纤维化的独立危险因素。同时血清HBV RNA与肝脏炎症坏死及纤维化程度呈正相关,这使其可以作为ALT水平正常的CHB人群一个潜在的血清学指标,其临床适用性待进一步验证。对于此类患者的抗病毒治疗需结合年龄、家族史、血清HBV DNA等综合评估的基础上,提高肝穿刺活检的普及性及必要性,更及时明确抗病毒治疗的启动时机,以免延误最佳治疗时机,及时抑制病毒复制,延缓疾病发展。但本研究样本量较小,且来源于单中心,需大规模和多中心队列进一步研究未经治疗的CHB患者的血清HBV RNA,提供更多的循证医学证据。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240512



