Cancer Cell:四川大学石虎兵/马学磊合作揭示免疫检查点介导循环肿瘤细胞逃避NK细胞监测的分子机制
时间:2023-01-28 12:01:35 热度:37.1℃ 作者:网络
循环肿瘤细胞(Circulating tumor cells,CTCs)由原发恶性肿瘤脱落,起着远处转移的“种子”作用。然而,目前还不清楚CTCs是如何逃脱免疫监测的。
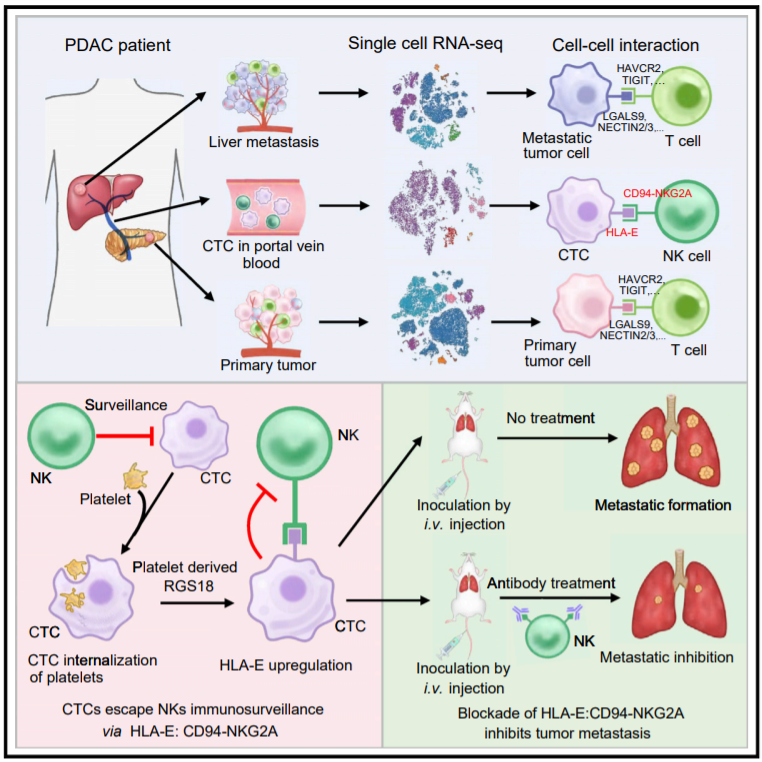
2023年1月26日,四川大学石虎兵及马学磊共同通讯在Cancer Cell 杂志在线发表题为“Immune checkpoint HLA-E:CD94-NKG2A mediates evasion of circulating tumor cells from NK cell surveillance”的研究论文,该研究在单细胞尺度上描述了人胰腺导管腺癌CTCs、原发性和转移性病变的转录组。体外和体内的细胞相互作用分析和功能研究表明,CTCs和自然杀伤细胞(NK)通过免疫检查点分子对HLA-E:CD94-NKG2A相互作用。通过阻断NKG2A或抑制HLA-E表达来破坏这种相互作用可以增强NK介导的体外肿瘤细胞杀伤,并在体内防止肿瘤转移。机制研究表明,血小板源性RGS18通过AKT-GSK3β-CREB信号通路促进HLA-E表达,RGS18过表达促进胰腺肿瘤肝转移。
总之,该研究表明血小板来源的RGS18通过参与免疫检查点HLA-E:CD94-NKG2A保护CTCs免受NK介导的免疫监测。抑制信号的中断可以通过免疫消除CTCs来防止体内肿瘤转移。

免疫检查点封锁(Immune checkpoint blockade,ICB)已经彻底改变了多种癌症类型的治疗。该方案的突破很大程度上得益于对肿瘤免疫逃避的认识的提高。免疫防御和自我耐受之间的平衡是由免疫检查点分子对微妙地控制的。肿瘤细胞通过劫持机制并假装是健康自我组织的一部分来逃避基于T细胞的免疫监视。通过阻断抑制检查点,药物释放免疫抑制调节,恢复T淋巴细胞的肿瘤特异性细胞毒性。
在过去的十年中,FDA已经批准了7种单克隆抗体药物,阻断PD-1:PD-L1和CTLA-4:B7-1/ B7-2的相互作用,用于20多种适应症,包括转移性黑色素瘤、非小细胞肺癌、肾癌、肝细胞癌等。最近,一项针对黑色素瘤患者的6年随访研究显示,抗PD-1单药治疗可持续抑制肿瘤,表明具有可靠的长期获益。尽管取得了巨大的成功,但显著的反应仅限于少数患者和少数适应症,这突出了通过针对其他潜在免疫检查点开发更有效的方案的需求。
目前,在实体肿瘤的原发或转移小生境中,肿瘤细胞与不同类型的免疫细胞之间的免疫检查点分子对已经得到了广泛的研究。然而,对循环中肿瘤细胞的免疫监测研究较少。由于血液循环是肿瘤从原始位点向远处器官转移的主要途径,对血液中肿瘤细胞与免疫细胞相互作用的研究可能提供一种通过激活宿主免疫消除系统来中断转移的策略。研究(1)在循环中移动的肿瘤细胞是否会受到免疫细胞的攻击;(2)哪种类型的免疫细胞具有免疫消除功能;(3)循环肿瘤细胞(CTCs)如何通过抑制检查点对逃脱这种免疫监视。
为了解决这些问题,研究人员采用了一种通过血液循环的肿瘤转移的典型模型,胰腺导管腺癌(PDAC)。根据文献记载,PDAC是最致命的恶性肿瘤之一,5年生存率约为8%阻碍生存益处的一个主要障碍是,这种恶性肿瘤的侵袭性与向邻近器官(主要是肝脏)的高度转移播散有关。病理和解剖学研究表明,PDAC主要通过肝门静脉(HPV)系统从胰腺原发病变转移到肝脏。因此,HPV血液中的CTCs代表了肿瘤细胞在循环中的中间状态。在HPV中消除CTCs可能潜在地中断肿瘤转移的途径。
在这项研究中,研究人员在单细胞尺度上描述了血液循环和实体(原发性和转移性)恶性病变中肿瘤-免疫细胞的相互作用。通过系统分析免疫相关分子对,研究发现了一个特异性免疫检查点HLA-E:CD94-NKG2A,它介导了自然杀伤细胞(NK)免疫监测中的CTC免疫逃避。中断相互作用可以通过恢复NK细胞毒性来阻止胰腺肿瘤的转移,这为预防CTCs介导的肿瘤转移提供了一种有效的策略。
研究概述(图源自Cancer Cell )
总的来说,该研究观察到CTCs内化血小板而逃避免疫监测。通过吸收血小板,CTCs获得生物功能大分子,包括蛋白质和mRNA。这些分子可能以转录依赖或独立的方式影响受体细胞的信号转导。血小板内化的确切机制有待进一步研究。
原文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00001-6#


